
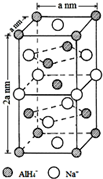
 氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示.
氢化铝钠(NaAlH4)是一种新型轻质储氢材料,掺入少量Ti的NaAlH4在150℃时释氢,在170℃、15.2MPa条件下又重复吸氢.NaAlH4可由AlCl3和NaH在适当条件下合成.NaAlH4的晶胞结构如图所示. .
. .
. (标明配位键).
(标明配位键).分析 (1)Ti原子核外电子数为22,价电子排布式为3d24s2,结合泡利原理、洪特规则画出价电子排布图;
(2)NaH的熔点为800℃,不溶于有机溶剂,应使用离子晶体,用钠离子与氢负离子构成;
(3)氯化铝在178℃时升华,熔沸点较低,属于分子晶体,蒸气的相对分子质量约为267,蒸气分子的分子式为Al2Cl6,铝原子最外层电子只有3个电子,形成3个共价键,每个铝原子和四个氯原子形成共价键,且其中一个共用电子对是氯原子提供形成的配位键;
(4)AlH4-中,Al的轨道杂化数目为4+$\frac{3+1-1×4}{2}$=4,Al采取sp3杂化,为正四面体构型;
(5)以体心的AlH4-研究,与之紧邻且等距的Na+位于晶胞棱之间、晶胞中上面立方体左右侧面面心、晶胞中下面立方体前后面的面心,与AlH4-紧邻且等距的Na+有8个,根据均摊法可知,晶胞中AlH4-数目为1+8×$\frac{1}{8}$+4×$\frac{1}{2}$=4,Na+数目为6×$\frac{1}{2}$+4×$\frac{1}{4}$=4,则二者配位数相等;
结合晶胞中AlH4-、Na+数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算密度;
若NaAlH4晶胞底心处的Na+被Li+取代,可知晶胞中Li+为1,再计算Na+数目,而晶胞中AlH4-数目不变,可得化学式;
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,根据原子守恒可知:3NaAlH4→Na3AlH6+2Al+3H2↑.
解答 解:(1)Ti原子核外电子数为22,价电子排布式为3d24s2,价电子排布图为 ,
,
故答案为: ;
;
(2)NaH的熔点为800℃,不溶于有机溶剂,应使用离子晶体,用钠离子与氢负离子构成,电子式为 ,
,
故答案为: ;
;
(3)氯化铝在178℃时升华,熔沸点较低,属于分子晶体,蒸气的相对分子质量约为267,蒸气分子的分子式为Al2Cl6,铝原子最外层电子只有3个电子,形成3个共价键,每个铝原子和四个氯原子形成共价键,且其中一个共用电子对是氯原子提供形成的配位键,结构式如图 ,
,
故答案为: ;
;
(4)AlH4-中Al的轨道杂化数目为4+$\frac{3+1-1×4}{2}$=4,Al采取sp3杂化,为正四面体构型,与AlH4-空间构型相同的两种离子为NH4+、SO42-等,
故答案为:sp3杂化;NH4+、SO42-等;
(5)根据均摊法可知,晶胞中AlH4-数目为1+8×$\frac{1}{8}$+4×$\frac{1}{2}$=4,Na+数目为6×$\frac{1}{2}$+4×$\frac{1}{4}$=4,则二者配位数为1:1,以体心的AlH4-研究,与之紧邻且等距的Na+位于晶胞棱之间、晶胞中上面立方体左右侧面面心、晶胞中下面立方体前后面的面心,与AlH4-紧邻且等距的Na+有8个,则与Na+紧邻且等距的AlH4-有8个;
晶胞质量为4×$\frac{54}{{N}_{A}}$g,晶胞密度为4×$\frac{54}{{N}_{A}}$g÷[(a×10-7 cm)2×2a×10-7 cm]=$\frac{108×1{0}^{21}}{{{N}_{A}a}^{3}}$g•cm-3,
若NaAlH4晶胞底心处的Na+被Li+取代,可知晶胞中Li+为1,Na+数目为3,而晶胞中AlH4-数目不变,可得化学式Na3Li[AlH4]4,
故答案为:8;$\frac{108×1{0}^{21}}{{{N}_{A}a}^{3}}$;Na3Li[AlH4]4;
(6)NaAlH4的释氢机理为:每3个AlH4-中,有2个分别释放出3个H原子和1个Al原子,同时与该Al原子最近邻的Na原子转移到被释放的Al原子留下的空位,根据原子守恒可知:3NaAlH4→Na3AlH6+2Al+3H2,反应方程式为:3NaAlH4=Na3AlH6+2Al+3H2↑,
故答案为:3NaAlH4=Na3AlH6+2Al+3H2↑.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、晶体类型与性质、杂化方式与空间构型、晶胞结构与计算等,题目素材中学基本不接触,容易是学生产生畏惧感,侧重考查学生对知识的迁移应用,(6)中注意利用原子守恒进行晶胞,避免考虑结构问题.


科目:高中化学 来源: 题型:解答题
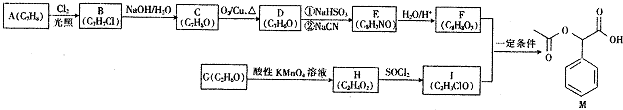
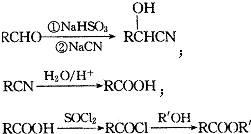 ;
;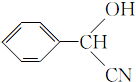 ;
; ;
;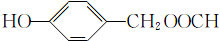 (填结构简式).
(填结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
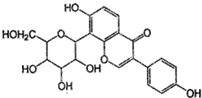
| A. | 该物质在一定条件下能发生消去反应、加成反应、取代反应 | |
| B. | 葛根素的分子式为C21H22O9 | |
| C. | 一定条件下1mol 该物质与浓溴水反应最多能消耗3mol Br2 | |
| D. | 一定条件下1mol 该物质与H2反应最多能消耗7mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O | |
| B. | 向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| C. | 氧化亚铁溶于稀硝酸:3FeO+8H++NO3-═3Fe3++NO↑+4H2O | |
| D. | 将0.4 mol•L-1的NaAlO2溶液和0.7 mol•L-1的盐酸等体积混合:4AlO${\;}_{2}^{-}$+7H++H2O═3Al(OH)3↓+Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y元素含氧酸的酸性比W的弱 | |
| B. | Z和W在自然界均能以游离态存在 | |
| C. | YZ和YZ2均可以被NaOH溶液吸收 | |
| D. | X和Y能形成既含极性键又含非极性键的分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
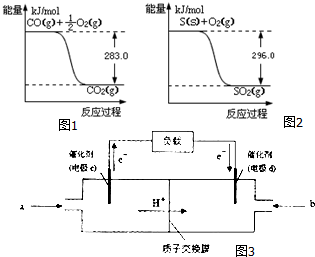 一氧化碳是一种用途广泛的化工基础原料.有机物加氢反应中镍是常用的催化剂.但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资
一氧化碳是一种用途广泛的化工基础原料.有机物加氢反应中镍是常用的催化剂.但H2中一般含有微量CO会使催化剂镍中毒,在反应过程中消除CO的理想做法是投入少量SO2,为弄清该方法对催化剂的影响,查得资查看答案和解析>>
科目:高中化学 来源: 题型:解答题

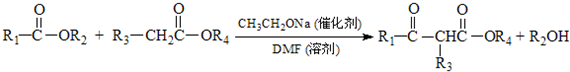
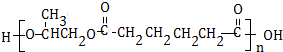 .
.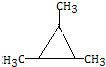 .
.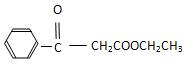
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中C的氢化物稳定性最强 | |
| B. | 同周期元素中A的金属性最强 | |
| C. | 原子半径:A>B,离子半径:A+>C- | |
| D. | A、B、C的简单离子中,会破坏水的电离平衡的是C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com