
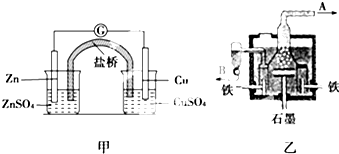
| A. | 甲装置中锌为负极,发生氧化反应,SO42-向铜极移动 | |
| B. | 乙装置中B是氯气出口,A是钠出口 | |
| C. | 乙装置中铁极为阳极,石墨为阴极 | |
| D. | 甲装置中的反应是自发反应,有化学能转化为电能;乙装置中的反应是非自发反应,有电能转化为化学能 |
分析 A、原电池中,活泼性强的作负极,失电子发生氧化反应,阴离子移向负极;
B、氯离子在阳极上转化为氯气,Na+在阴极上得电子生成Na;
C、电解熔融氯化钠时应该用惰性电极作阳极;
D、根据甲装置为原电池装置,化学能转化为电能;乙装置为电解池,由电能转化为化学能判断.
解答 解:A、原电池中,活泼性强的作负极,所以甲装置中锌为负极,失电子发生氧化反应,阴离子移向负极,所以SO42-向锌极移动,故A错误;
B、氯离子在阳极上转化为氯气,则A是氯气出口,Na+在阴极上得电子生成Na,则B是钠出口,故B错误;
C、电解熔融氯化钠时应该用惰性电极作阳极,如果Fe作阳极,则Fe在阳极失电子,所以C为阳极,电极反应式为2Cl--2e-═Cl2↑,故C错误;
D、因为甲装置为原电池装置,所以有化学能转化为电能;乙装置为电解池,有电能转化为化学能,故D正确;
故选D.
点评 本题考查了原电池和电解池原理的应用,涉及电极的判断、电极反应式的书写等,注意对基础知识的归纳整理,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 卤代烃一般易溶于水,常用作有机溶剂 | |
| B. | 苯酚是重要的有机化工原料,可用于制备酚醛树脂 | |
| C. | 乙二醇水溶液的凝固点低,可用作汽车发动机的抗冻剂 | |
| D. | 福尔马林具有防腐杀菌作用,能用于浸制生物标本 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌是正极,氧化银是负极 | |
| B. | 锌发生还原反应,氧化银发生氧化反应 | |
| C. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| D. | 随着电极反应的不断进行,电解质溶液的pH基本保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将大小、形状相同的镁条和铝条与相同浓度、相同温度下的盐酸反应时,两者快慢相同 | |
| B. | 盛有相同浓度双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快 | |
| C. | 将浓硝酸分别放在冷暗处和强光下,发现强光下的浓硝酸分解得快 | |
| D. | 升高温度,H2O2的分解速率加快,原因是反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水和碘化钾反应:Cl2+2I-=2Cl-+I2 | |
| B. | 盐酸与AgNO3溶液反应:HCl+Ag+=H++Ag Cl↓ | |
| C. | 氢氧化钙溶液吸收氯气:Cl2+2OH-=Cl-+ClO-+H2O | |
| D. | 二氧化锰和盐酸制氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com