
【题目】短周期元素X、Y、Z、W在周期表中的位置关系如图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。

(1)X元素在元素周期表中的位置________。
(2)X、Y、Z元素的简单气态氢化物中,稳定性最差的是________(用分子式表示)。
(3)Y、Z、W三种元素对应的离子中,半径由大到小的顺序____________(用离子符号表示)。
(4)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式_______________。关于该电池的下列说法,正确的是_________。

A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(5)X2Z42-能被酸性KMnO4氧化,请填写相应的离子,并给予配平:
_____ ______+______MnO4- + ________H+ = ______CO2 + _______Mn2++______H2O
【答案】第二周期第ⅣA 族 CH4 r(N3-)>r(O2-)>r(Al3+) CO+O2- -2e-=CO2 AC 5 C2O42- 2 16 10 2 8
【解析】
根据短周期元素X、Y、Z、W在周期表中的位置关系,则X、Y、Z是第二周期的元素,W是第三周期的元素;同周期元素的常见简单离子中,W的简单离子半径最小,W是Al元素;根据相对位置,X、Y、Z分别是C、N、O。
(1)X是C元素,在元素周期表中的位置是第二周期第ⅣA 族;
(2)同周期元素从左到右非金属性增强,非金属性越强,气态氢化物越稳定,C、N、O元素的简单气态氢化物中,稳定性最差的是CH4;
(3)N、O、Al三种元素对应的离子,电子层数相同,质子数越多,半径越小,半径由大到小的顺序r(N3-)>r(O2-)>r(Al3+);
(4)原电池负极发生氧化反应、正极发生还原反应,负极是一氧化碳失电子生成二氧化碳,负极反应式CO+O2--2e-=CO2;
A.b通入氧气,氧气发生还原反应,工作时电极b作正极,O2- 通过固体介质NASICON由电极b流向电极a,故A正确;
B.电流由正极流向负极,b是正极,工作时电流由电极b通过传感器流向电极a,故B错误;
C.CO的含量越高,失电子越多,传感器中通过的电流越大,故C正确;
(5)C2O42-被酸性KMnO4氧化为CO2,根据得失电子守恒、电荷守恒、元素守恒,相应的离子方程式是5C2O42-+2MnO4- +16H+ =10CO2 +2Mn2++8H2O。


科目:高中化学 来源: 题型:
【题目】(一)工业上,在Cu2O/ZnO 作催化剂的条件下发生反应:CO(g)+2H2(g)CH3OH(g) △H
(1)已知:CH3OH(l)=CH3OH(g) △H=+35.2kJmol-1,根据表:
物质 | H2(g) | CO(g) | CH3OH(l) |
燃烧热/kJmol-1 | -285.8 | -283.0 | -726.5 |
反应CO(g)+2H2(g)CH3OH(g) △H=______kJmol-1
(2)向2L恒容密闭容器中通入1mol CO(g)和2mol H2(g),发生反应合成甲醇,反应过程中n(CH3OH)与时间(t)及温度的关系如图1所示。在500℃恒压条件下,请在图1中画出反应体系中n(CH3OH)与时间(t)变化总趋势图。
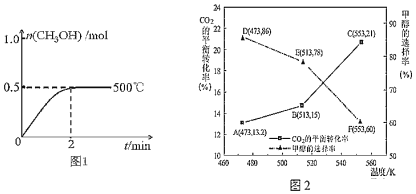 ____________
____________
(二)甲醇还可用CO2与H2在催化剂CZZA(普通铜基催化剂)作用下合成,相关反应如下:
反应ⅠCO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=-49.2kJmol-1
反应ⅡCO2(g)+H2(g)CO(g)+H2O(g) △H2=41.2kJmol-1
(3)以CZZA/rGO为催化剂,在一定条件下,将1mol CO2与3mol H2通入恒容密闭容器中进行反应I和反应II,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的CO2中生成甲醇的物质的量分数)随温度的变化趋势如图2所示:
①在553K时,反应体系内CO的物质的量为______ mol
②随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,请分析其原因:______
(三)(4)如图为氯碱工业的装置示意图,a端进入的物质为______,工业上还可以利用该装置,以四甲基氯化铵[(CH3)4NCl]水溶液为原料,通过电解法可制备四甲基氢氧化铵[(CH3)4NOH],则收集到(CH3)4NOH的区域是______(填a、b、c或d),
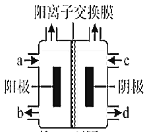
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电-Fenton法是用于水体中有机污染物降解的高级氧化技术,反应原理如图所示。电解产生的H2O2与Fe2+发生反应生成的羟基自由基(·OH)能氧化降解有机污染物。下列说法错误的是

A.电源的A极为负极
B.与电源B极相连电极的电极反应式为H2O-e- =H++·OH
C.Fenton反应为:H2O2+Fe2+=Fe(OH)2++·OH
D.每消耗2.24LO2(标准状况),整个电解池中理论上可产生的·OH为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )

A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu﹣Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn﹣MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列变化的方程式是
A.HSO3-电离:HSO3-+H2O![]() SO32-+ H3O+
SO32-+ H3O+
B.NaHCO3溶液中加入少量盐酸:CO32-+2H+=CO2↑+ H2O
C.KI 溶液中加入 H2SO4 和 H2O2: 2I-+H2O2 =I2+2OH-
D.用石墨电极电解 CuCl2溶液 :Cu2++2C1-+2H2O![]() Cu(OH)2↓+H2↑ + Cl2 ↑
Cu(OH)2↓+H2↑ + Cl2 ↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)比较结合e-能力的相对强弱:Cl2__________S(填“>”或“<”);用一个离子方程式说明Cl2和S结合e-能力的相对强弱_______。
(2)KCN 是离子化合物,各原子均满足8 电子稳定结构。写出 KCN的电子式______。
(3)在常压下,CBr4的沸点(190℃)比CCl4的沸点(76.8℃)高。主要原因是 ____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液450mL和0.5 mol·L-1硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是_______(填序号),配制上述溶液还需用到的玻璃仪器是_________(填仪器名称)。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为______g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度_____(填“偏高”、“偏低”或“不变”);
③若NaOH固体溶解后立即移入容量瓶→洗涤烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度________(填“偏高”、“偏低”或“不变”)。
(3)在配制硫酸溶液时:
①需量取质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积_______ml;
②在配制硫酸溶液时需先在烧杯中将浓硫酸进行稀释,稀释时的操作方法是_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I的形式存在,几种粒子之间的转化关系如图所示。已知淀粉遇单质碘变蓝,下列说法中正确的是

A. 向含I的溶液中通入Cl2,所得溶液加入淀粉溶液一定变蓝
B. 途径II中若生成1 mol I2,消耗1 mol NaHSO3
C. 氧化性的强弱顺序为Cl2>I2>IO3
D. 一定条件下,I与IO3可能生成I2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com