【答案】
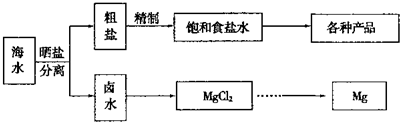
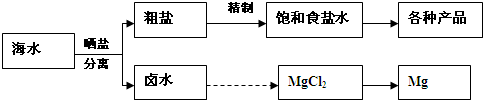
分析:(1)A.K元素在海水中主要以钾离子形式存在;
B.海水通过蒸发可得到粗盐,通过蒸馏可得到淡水;
C.海水中含有溴化物,从海水中可制取溴及其化工产品;
D.利用朝汐发电,没有发生化学反应;
(2)工业上用电解熔融的MgCl
2制备金属镁,电解熔融的氯化镁生成镁与氯气;
(3)①阳极发生氧化反应,氯离子在阳极放电生成氯气;
②由题意可知,电解饱和食盐水制备“84”消毒液,生成次氯酸钠与氢气;
次氯酸钠是强碱弱酸盐,次氯酸根水解,溶液呈碱性;
(4)负极发生氧化反应,氢气在负极放电,在碱性条件下生成水,酸性条件下生成氢离子;
解答:解:(1)A.K元素在海水中主要以钾离子形式存在,必须通过化学变化获得K单质,故A错误;
B.海水通过蒸发可得到粗盐,通过蒸馏可得到淡水,故B错误;
C.海水中含有溴化物,从海水中可制取溴及其化工产品,故C正确;
D.利用朝汐发电是朝汐能转化为电能,没有发生化学反应,而化学能转化为电能必须要发生化学反应,故D错误;
故答案为:C;
(2)工业上用电解熔融的MgCl
2制备金属镁,电解熔融的氯化镁生成镁与氯气,反应化学方程式为MgCl
2
Mg+Cl
2↑,
故答案为:MgCl
2
Mg+Cl
2↑;
(3)①阳极发生氧化反应,氯离子在阳极放电生成氯气,电极反应式为:2Cl
--2e
-=Cl
2↑,
故答案为:2Cl
--2e
-=Cl
2↑;
②由题意可知,电解饱和食盐水制备“84”消毒液,阴极生成氢气,阳极生成的氯气与氢氧化钠反应生成次氯酸钠、氯化钠,最终生成生成次氯酸钠与氢气,反应的总方程式为:NaCl+H
2O

NaClO+H
2↑;
次氯酸钠是强碱弱酸盐,次氯酸根水解ClO
-+H
2O?HClO+OH
-,破坏水的电离平衡,溶液呈碱性,故pH>7,
故答案为:NaCl+H
2O

NaClO+H
2↑;>;ClO
-+H
2O?HClO+OH
-;
(4)负极发生氧化反应,氢气在负极放电,在碱性条件下生成水,电极反应式为:H
2-2e
-+2OH
-=2H
2O;
酸性条件下生成氢离子,电极反应式为:H
2-2e
-=2H
+,
故答案为:H
2-2e
-+2OH
-=2H
2O或H
2-2e
-=2H
+.
点评:本题考查海水资源的综合利用、电解原理、燃料电池、常用化学用语等,难度中等,注意根据氧化还原反应理解原电池与电解池原理.

 Mg+Cl2↑,
Mg+Cl2↑, Mg+Cl2↑;
Mg+Cl2↑; NaClO+H2↑;
NaClO+H2↑; NaClO+H2↑;>;ClO-+H2O?HClO+OH-;
NaClO+H2↑;>;ClO-+H2O?HClO+OH-;