
| A. | 平衡向正反应方向移动 | B. | a+b>c+d | ||
| C. | C的体积分数降低 | D. | B的转化率升高 |
分析 假定平衡不移动,将气体体积压缩到原来的一半,D的浓度为原来的2倍,实际再次达到新平衡时,D的浓度为原来的1.8倍,说明压强增大,平衡向逆反应移动,即a+b<c+d,依据平衡移动方向分析选项.
解答 解:假定平衡不移动,将气体体积压缩到原来的一半,D的浓度为原来的2倍,实际再次达到新平衡时,D的浓度为原来的1.8倍,说明压强增大,平衡向逆反应移动,即a+b<c+d,
A.平衡向逆反应方向移动,A的转化率变小,故A错误;
B.增大压强,平衡向气体体积减小的方向移动,该平衡向逆反应方向移动,所以a+b<c+d,故B错误.
C.平衡向逆反应方向移动,C的体积分数减小,故C正确;
D.平衡向逆反应方向移动,B转化率减小,故B错误;
故选C.
点评 本题考查平衡移动,正确判断气体体积刚压缩的一瞬间D的浓度变化是解本题的关键,题目较简单.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 1molCO2的质量为44g/mol | |
| B. | CO2的摩尔质量为44g | |
| C. | CO2的摩尔质量等于CO2的相对分子质量 | |
| D. | NA个CO2的质量与CO2的相对分子质量在数值上相同(NA为阿伏加德罗常数) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
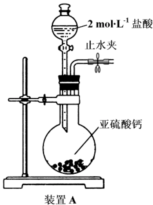


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某温度时,化学反应速率无论用A、B、C何种物质表示,其数值都是相同的 | |
| B. | 其它条件不变时,升高温度,反应速率加快 | |
| C. | 其它条件不变时,增大压强,反应速率加快 | |
| D. | 若增加或减少A物质的量,反应速率一定会发生明显的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
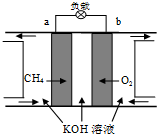
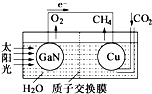 人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.科学家用氮化镓材料与铜组装如图的人工光合系统,成功地实现了以CO2和H2O合成CH4,下列说法不正确的是( )
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.科学家用氮化镓材料与铜组装如图的人工光合系统,成功地实现了以CO2和H2O合成CH4,下列说法不正确的是( )| A. | 该过程是将太阳能转化为化学能的过程 | |
| B. | GaN表面发生氧化反应,有O2产生 | |
| C. | 电解液中的H+从质子交换膜右侧向左侧迁移 | |
| D. | Cu表面的电极反应式 CO2+8e-+8H+═CH4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
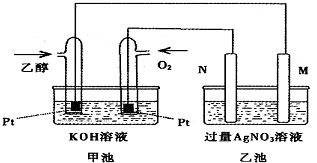 甲乙两池均是电化学装置,按下图连接.乙池中的两个电极分别是石墨电极和铁电极,已知工作过程M、N两个电极的质量均不减少,则下列说法正确的是( )
甲乙两池均是电化学装置,按下图连接.乙池中的两个电极分别是石墨电极和铁电极,已知工作过程M、N两个电极的质量均不减少,则下列说法正确的是( )| A. | M电极的材料是石墨 | |
| B. | 若乙池中某一电极质量增加4.32g时,理论上甲池消耗氧气为224mL | |
| C. | 在此过程中,甲池中OH-向通乙醇的一极移动 | |
| D. | 在此过程中,乙池溶液中电子从M电极向N电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
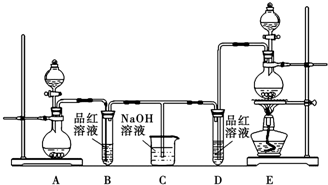
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 全球气候变暖已经成为全世界人类面临的重大问题.
全球气候变暖已经成为全世界人类面临的重大问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com