
分析 当溶液中离子浓度小于1.0×10-5mol•L-1可以认为完全沉淀,常温时,Fe(OH)3的Ksp=1×10-39,要使溶液中的Fe3+沉淀完全,残留在溶液中的c(Fe3+)<10-5mol•L-1,据Ksp计算.
解答 解:当溶液中离子浓度小于1.0×10-5mol•L-1可以认为完全沉淀,Ksp=c(Fe3+)c3(OH-)=10-5×c3(OH-)=1×10-39
c(OH-)=$\root{3}{\frac{1{0}^{-38}}{1{0}^{-5}}}$mol/L=10-11mol/L,c(H+)=$\frac{1{0}^{-14}}{c(O{H}^{-})}$mol/L=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=10-3mol/L,pH=3,故答案为:3.
点评 本题考查了沉淀的溶度积计算以及pH的计算,题目难度不大,注意题给条件即可.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沸点:NH3>H2O>H2S | |
| B. | 酸性:H2SO4>HClO4>H3PO3 | |
| C. | 结合质子的能力:CO32->ClO->CH3COO- | |
| D. | 气态氢化物的热稳定性:H2O>HF>NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学键 | C-C | C═C | C≡C | C-H | H-H | Cl-Cl | H-Cl |
| 键焓(△H)/kJ•mol-1 | 347.7 | 615.0 | 812.0 | 413.4 | 436.0 | 242.7 | 431 |
| A. | CH2═CH2(g)+H2(g)→CH3CH3(g)△H=+123.5 kJ•mol-1 | |
| B. | CH≡CH(g)+2H2(g)→CH3CH3(g)△H=-317.3 kJ•mol-1 | |
| C. | 稳定性:H-H键<H-Cl键<C-H键 | |
| D. | 由上表数据可计算乙烷与氯气发生一氯代反应的焓变(△H) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉长期放置会被空气中的氧气氧化而变质 | |
| B. | 医用消毒酒精中乙醇的浓度为95% | |
| C. | 加活性炭吸附水中小颗粒物,净化水质的方法属于物理方法 | |
| D. | 黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,“硝”是指硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13.6g | B. | 12g | C. | 6g | D. | 3.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
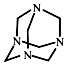
| A. | 化学式为C6H12N4,属于饱和烃 | |
| B. | 不能发生加成反应,一氯取代产物有3种 | |
| C. | 分子中既含极性共价键又含非极性共价键 | |
| D. | 可由甲醛(HCHO)与氨气按物质的量之比3:2完全反应制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
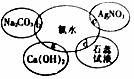 氯水具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(已知反应中氯水足量)
氯水具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(已知反应中氯水足量)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com