
·ÖĪö ¢ŁĮ½“ĪŹÕ¼Æµ½µÄĘųĢ嶼ŹĒ°±Ęų£¬¼ÓČėµÄNaOHĪļÖŹµÄĮæŅ»Ńł£¬µ«ŗóĄ“Éś³ÉµÄĘųĢåĢå»ż½ĻŠ”£¬ĖµĆ÷ĀČ»Æļ§²»×ćĮ棬n£ØNH3£©=$\frac{V}{{V}_{m}}$£»
¢Ś·¢ÉśµÄĄė×Ó·½³ĢŹ½ĪŖNH4Cl+NaOH=NH3”ü+H2O+NaCl£¬øł¾ŻNH3ŗĶNH4ClÖ®¼äµÄ¹ŲĻµŹ½¼ĘĖćc£ØNaOH£©£»
¢ŪĻČ¼ĘĖćČÜŅŗÖŠc£ØH+£©=$\frac{{K}_{w}}{c£ØO{H}^{-}£©}$£¬ČÜŅŗµÄpH=-lgc£ØH+£©£»
¢Üøł¾ŻNŌ×ÓŹŲŗć¼ĘĖćm£ØNH4Cl£©£¬ĀČ»Æļ§µÄÖŹĮæ·ÖŹż=$\frac{ĀČ»Æļ§ÖŹĮæ}{ѳʷ֏Įæ}$”Į100%£®
½ā“š ½ā£ŗ¢ŁĮ½“ĪŹÕ¼Æµ½µÄĘųĢ嶼ŹĒ°±Ęų£¬¼ÓČėµÄNaOHĪļÖŹµÄĮæŅ»Ńł£¬µ«ŗóĄ“Éś³ÉµÄĘųĢåĢå»ż½ĻŠ”£¬ĖµĆ÷ĀČ»Æļ§²»×ćĮ棬n£ØNH3£©=$\frac{V}{{V}_{m}}$=$\frac{2.24L+0.56L}{22.4L/mol}$=0.125mol£¬
“š£ŗÉĻŹö·“Ó¦£Ø±ź×¼×“æö£©ĻĀ¹²²śÉś°±ĘųµÄĪļÖŹµÄĮæ¹²0.125mol£»
¢Ś·¢ÉśµÄĄė×Ó·½³ĢŹ½ĪŖNH4Cl+NaOH=NH3”ü+H2O+NaCl£¬øł¾ŻNH3ŗĶNH4ClÖ®¼äµÄ¹ŲĻµŹ½µĆn£ØNaOH£©=n£ØNH3£©=0.125mol£¬c£ØNaOH£©=$\frac{0.125mol}{0.2L}$=0.625mol/L£¬
“š£ŗĒāŃõ»ÆÄʵÄĪļÖŹµÄĮæÅضČĪŖ0.625mol/L£»
¢ŪĻČ¼ĘĖćČÜŅŗÖŠc£ØH+£©=$\frac{{K}_{w}}{c£ØO{H}^{-}£©}$=$\frac{1{0}^{-14}}{0.625}$mol/L=1.6”Į10-14 mol/L£¬ČÜŅŗµÄpH=-lgc£ØH+£©=14-lg1.6=13.8£¬
“š£ŗČÜŅŗµÄpH=13.8£»
¢Üøł¾ŻNŌ×ÓŹŲŗćµĆn£ØNH4Cl£©=n£ØNH3£©=0.125mol£¬m£ØNH4Cl£©=0.125mol”Į53.5g/mol=6.69g£¬ĀČ»Æļ§µÄÖŹĮæ·ÖŹż=$\frac{ĀČ»Æļ§ÖŹĮæ}{ѳʷ֏Įæ}$”Į100%=$\frac{6.69g}{7g}$”Į100%=95.5%£¬
“š£ŗĀČ»Æļ§µÄ“æ¶ČĪŖ95.5%£®
µćĘĄ ±¾Ģāæ¼²é»Æѧ·½³ĢŹ½ÓŠ¹Ų¼ĘĖć£¬ĪŖøßĘµæ¼µć£¬²ąÖŲæ¼²éѧɜ·ÖĪö¼ĘĖćÄÜĮ¦£¬Ć÷Č·ø÷øöĪļĄķĮæÖ®¼äµÄ¹ŲĻµ¼°ÓŠ¹Ų¼ĘĖć£¬×¢ŅāŌ×ÓŹŲŗćµÄÕżČ·ŌĖÓĆ£¬ĢāÄæÄŃ¶Č²»“ó£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
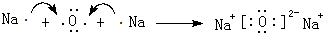 £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
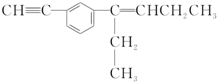
| A£® | øĆÓŠ»ś»ÆŗĻĪļŗ¬ÓŠ3ÖÖ¹ŁÄÜĶÅ | |
| B£® | øĆÓŠ»śĪļ·Ö×ÓÖŠ×ī¶ąÓŠ12øöĢ¼Ō×ÓŌŚĶ¬Ņ»Ę½ĆęÄŚ | |
| C£® | øĆÓŠ»śĪļ·Ö×ÓÖŠ×ī¶ąÓŠ6øöĢ¼Ō×Ó¹²Ļß | |
| D£® | øĆÓŠ»śĪļ·Ö×ÓÖŠ×ī¶ąÓŠ14øöĢ¼Ō×ÓŌŚĶ¬Ņ»Ę½ĆęÄŚ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | “Ł½ųĖ«Ėõėå·“Ó¦ | B£® | Ļū³żÉ«ĖŲĄą¶Ō±ČÉ«µÄøÉČÅ | ||
| C£® | “Ł½ųÄŃČÜŠŌĪļÖŹ³Įµķ | D£® | ±£³Ö·“Ó¦ĪļŃÕÉ«µÄĪČ¶Ø |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ī¬ĄÕÓĆĪŽ»śĪļŗĻ³ÉĮĖÄņĖŲ£¬Ķ»ĘĘĮĖĪŽ»śĪļÓėÓŠ»śĪļµÄ½ēĻŽ | |
| B£® | æŖ·¢ŗĖÄÜ”¢Ģ«ŃōÄܵȊĀÄÜŌ“£¬ĶĘ¹ćŅŅ“¼ĘūÓĶµČæÉÖ±½Ó½µµĶĢ¼ÅÅ·Å | |
| C£® | ŗģĶā¹āĘ×ŅĒ”¢ŗĖ“Ź²ÕńŅĒ”¢ÖŹĘ×ŅĒ¶¼æÉÓĆÓŚÓŠ»ś»ÆŗĻĪļ½į¹¹µÄ·ÖĪö | |
| D£® | ŹÆÓĶÖ÷ŅŖŹĒø÷ÖÖĶéĢž”¢»·ĶéĢž”¢Ļ©Ģž×é³ÉµÄ»ģŗĻĪļ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā

 £®
£®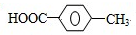 £¬¢Ś»ÆŗĻĪļSæÉŌŚŅ»¶ØĢõ¼žĻĀ·¢Éś·“Ӧɜ³Éøß¾ŪĪļ£¬Š“³öøĆ¾ŪŗĻ·“Ó¦·½³ĢŹ½£ŗ
£¬¢Ś»ÆŗĻĪļSæÉŌŚŅ»¶ØĢõ¼žĻĀ·¢Éś·“Ӧɜ³Éøß¾ŪĪļ£¬Š“³öøĆ¾ŪŗĻ·“Ó¦·½³ĢŹ½£ŗ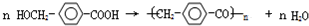 £®
£® ŗĶ
ŗĶ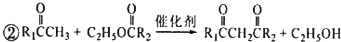 £¬MµÄ½į¹¹¼ņŹ½ĪŖ
£¬MµÄ½į¹¹¼ņŹ½ĪŖ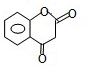 £®
£®²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com