
【题目】酸雨的主要成分是H2SO4,以下是形成途径之一:①NO2+SO2=NO+SO3,②2NO+O2=2NO2,③SO3+H2O=H2SO4,以下叙述错误的是
A. NO2由反应N2+2O2![]() 2NO2生成
2NO2生成
B. 总反应可表示为2SO2+O2+2H2O![]() 2H2SO4
2H2SO4
C. 还可能发生的反应有4NO2+O2+2H2O=4HNO3
D. 还可能发生的反应有4NO+3O2+2H2O=4HNO3
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】人们发现氧化铁硫杆菌能促使黄铁矿(FeS2)氧化成硫酸铁和硫酸,氧化铁硫杆菌能把矿物中的硫或硫化物氧化成硫酸,而硫酸和硫酸铁能将某些矿石中的金属元素转化成金属硫酸盐,从而开辟了“细菌冶金”的先河。氧化铁硫杆菌的活动过程如图所示,其中a过程发生的反应为4FeS2+15O2+2H2O![]() 2Fe2(SO4)3+2H2SO4。则下列说法错误的是
2Fe2(SO4)3+2H2SO4。则下列说法错误的是

A.a过程中释放能量
B.细菌在反应a过程中起了催化剂的作用
C.b过程类似于植物的光合作用,细菌将能量储存在C6H12O6中
D.有些细菌可直接把含铅、汞等重金属的矿石溶解,得到重金属离子的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】日常生活中常见电动自行车主要部件之铅蓄电池:PbO2+2H2SO4+Pb![]() PbSO4+H2O。有关说法不正确的是( )
PbSO4+H2O。有关说法不正确的是( )
A.该电池充电过程中电解质溶液pH值减小
B.该电池放电过程中将化学能转化为电能
C.放电过程中,电子由Pb电极经过导线流向PbO2
D.铅蓄电池放电过程中负极电极反应式为:Pb -2e-=Pb2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上高纯硅可以通过下列反应制取:SiCl4(g)+2H2(g)Si(s)+4HCl(g)﹣236kJ
(1)反应涉及的元素原子半径从大到小的排列顺序为_____。其中硅原子最外层有_____个未成对电子,有_____种不同运动状态的电子;
(2)反应涉及的化合物中,写出属于非极性分子的结构式:_____;产物中晶体硅的熔点远高HCl,原因是_____;
(3)氯和硫是同一周期元素,写出一个能比较氯和硫非金属性强弱的化学方程式:_____;
(4)在一定温度下进行上述反应,若反应容器的容积为2L,3分钟后达到平衡,测得气体质量减小8.4g,则在3分钟内H2的平均反应速率为_____;
(5)该反应的平衡常数表达式K=_____,可以通过_____使K增大;
(6)一定条件下,在密闭恒容器中,能表示上述反应一定达到化学平衡状态的是_____。
a.v逆(SiCl4)=2v正(H2)
b.固体质量保持不变
c.混合气体密度保持不变
d.c(SiCl4):c(H2):c(HCl)=1:2:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镁晶须是一种新型的吸波隐形材料中的增强材料。
(1)合成该物质的步骤如下:
步骤1:配制0.5mol·L-1MgSO4溶液和0.5mol·L-1NH4HCO3溶液。
步骤2:用量筒量取500mL NH4HCO3溶液于1000mL四口烧瓶中,开启搅拌器。温度控制在50℃。
步骤3:将250mL MgSO4溶液逐滴加入NH4HCO3溶液中,1min内滴加完后,用氨水调节溶液pH到9.5。
步骤4:放置1h后,过滤,洗涤。
步骤5:在40℃的真空干燥箱中干燥10h,得碳酸镁晶须产品(MgCO3·nH2O n=1~5)。
①步骤2控制温度在50℃,较好的加热方法是__________。
②步骤3生成MgCO3·nH2O沉淀的离子方程式为________。
③步骤4检验是否洗涤干净的方法是___________。
(2)测定合成的MgCO3·nH2O中的n值。
称量1.000g碳酸镁晶须,放入如图所示的广口瓶中加入水滴入稀硫酸与晶须反应,生成的CO2被NaOH溶液吸收,在室温下反应4~5h,反应后期将温度升到30℃,最后的烧杯中的溶液用已知浓度的盐酸滴定,测得CO2的总量;重复上述操作2次。

①图中气球的作用是___________。
②上述反应后期要升温到30℃,主要目的是_________。
③设3次实验测得每1.000g碳酸镁晶须产生的CO2平均值为a mol,则n值为______(用含a的表达式表示)。
(3)称取100g上述晶须产品进行热重分析,热重曲线如图。

则该条件下合成的晶须中,n=______(选填:1、2、3、4、5)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是
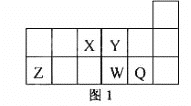
A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>:rZ>rW>rQ
C. 离子Y2-和Z 3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组对电化学问题进行了实验探究。
Ⅰ.利用如图装置探究金属的防护措施,实验现象是锌电极不断溶解,铁电极表面有气泡产生。

(1)写出负极的电极反应式_______________。
(2)某学生认为,铁电极可能参与反应,并对产物作出假设:
假设1:铁参与反应,被氧化生成Fe2+
假设2:铁参与反应,被氧化生成Fe3+
假设3:____________。
(3)为了探究假设1、2,他采取如下操作:
①取0.01 mol·L-1FeCl3溶液2 mL于试管中,加入过量铁粉;
②取操作①试管的上层清液加入2滴K3[Fe(CN)6]溶液,生成蓝色沉淀;
③取少量正极附近溶液加入2滴K3[Fe(CN)6]溶液,未见蓝色沉淀生成;
④取少量正极附近溶液加入2滴KSCN溶液,未见溶液变血红;
据②、③、④现象得出的结论是______________。
(4)该实验原理可应用于防护钢铁腐蚀,请再举一例防护钢铁腐蚀的措施_________________。
Ⅱ.利用如图装置作电解50 mL 0.5 mol·L-1的CuCl2溶液实验。

实验记录:
A.阳极上有黄绿色气体产生,该气体使湿润的淀粉碘化钾试纸先变蓝后褪色(提示:Cl2氧化性大于IO3-);
B.电解一段时间以后,阴极表面除有铜吸附外,还出现了少量气泡和浅蓝色固体。
(1)分析实验记录A中试纸颜色变化,用离子方程式解释:①________________;②___________。
(2)分析实验记录B中浅蓝色固体可能是____(写化学式),试分析生成该物质的原因______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核能的和平利用对于完成“节能减排”的目标有着非常重要的意义。尤其是核聚变,因其释放能量大,无污染,成为当前研究的一个热门课题。其反应原理为![]() +
+![]() →
→![]() +
+![]() 。下列说法中正确的是( )
。下列说法中正确的是( )
A.D和T是质量数不同,质子数相同的氢的两种元素
B.通常所说的氢元素是指![]()
C.![]() 、
、![]() 、
、![]() 是氢的三种核素,互为同位素
是氢的三种核素,互为同位素
D.这个反应既是核反应,也是化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为________
(2)NiO、FeO的晶体结构类型均与氯化钠的相同、Fe2+和Ni2+的离子半径分别78pm和69pm,则熔点FeO________ (填“<”或“>”) NiO;
(3)[Ni(NH3)6]SO4中阴离子的立体构型是_____。氨的沸点____(填“高于”或“低于”)膦(PH3),原因是_________;
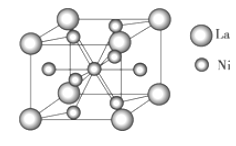
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示。该合金的化学式为________;
(5)某镍白铜合金的立方晶胞结构如图所示。
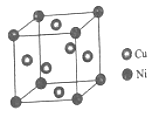
①晶胞中镍原子的堆积模型名称是_____。
②元素铜与镍的第二电离能分别为:ICu=1959kJ/mol,INi=1753kJ/mol,ICu>INi的原因是______
③若合金的密度为dg/cm3,晶胞参数(即边长)a =________nm
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com