
| A. | 78g Na2O2与足量水充分反应时电子转移数为2NA | |
| B. | 25℃、101.3kPa时,11.2L H2中含有的原子数为NA | |
| C. | 4℃、101.3kPa时,54mL H2O中含有的分子数为3NA | |
| D. | 2L 1mol/L Na2SO4溶液中离子总数为3NA |
分析 A.过氧化钠与水反应为歧化反应;
B.25℃、101.3kPa,不是标准状况;
C.4℃、101.3kPa时,水的密度为1g/mL,结合n=$\frac{m}{M}$计算解答;
D.1mol硫酸钠含有2mol钠离子和1mol硫酸根离子.
解答 解:A.过氧化钠与水反应为歧化反应,1mol过氧化钠与水反应转移1mol电子,则78g Na2O2物质的量为1mol,与足量水充分反应时电子转移数为NA,故A错误;
B.25℃、101.3kPa时,Vm≠22.4L/mol,Vm不确定,无法计算原子个数,故B错误;
C.4℃、101.3kPa时,54mL H2O质量为54g,物质的量为:$\frac{54g}{18g/mol}$=3mol,含有的分子数为3NA,故C正确;
D.2L 1mol/L Na2SO4溶液中硫酸钠的物质的量为2L×1mol/L=2mol,含有4mol钠离子和2mol硫酸根离子,共含有离子总数为6NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,题目难度不大,注意气体摩尔体积使用条件和对象.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 若将四种溶液稀释100倍,稀释后溶液pH大小顺序:③>④>②>① | |
| B. | 等体积的③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③>④ | |
| C. | 等体积的②和③混合生成强酸弱碱盐,混合后溶液呈酸性 | |
| D. | 等体积的①和②分别与足量的锌粒反应生成的氢气在同温同压下体积:①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
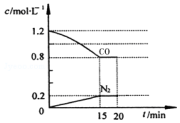 回答下列问题:
回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结 论 | |
| ① | SO2使酸性高锰酸钾溶液褪色 | 可证SO2有漂白性 |
| ② | 用磨口玻璃瓶保存NaOH溶液,用热的纯碱溶液淸洗容器里附有的油污 | 都发生了氧化还原反应 |
| ③ | 取少量Na2SO3样品加入Ba(NO3)2溶液后,产生白色沉淀,滴加稀盐酸,沉淀不溶解 | 证明Na2SO3已氧化变质 |
| ④ | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,该溶液滴加CaCl2溶液,有白色沉淀'生成 | 确定该溶液存在CO32- |
| ⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
| A. | ①② | B. | ③④⑤ | C. | ②④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
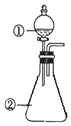 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D | 亚硫酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | CCl4起到萃取、富集I2的作用 | |
| B. | a中下层变无色,说明I2 转化为I- | |
| C. | Ⅲ中发生反应的离子方程式为:Br2+2I-═I2+2Br- | |
| D. | 只依据a、b中现象,不可以证明Cl2的氧化性比 Br2强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在地球上元素的分布和它们在元素周期表中的位置有密切关系 | |
| D. | 在金属元素区域可以寻找制备新型农药材料的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
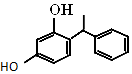 杨树生长迅速,高大挺拔,树冠有昂扬之势.其体内有一种有机物,结构如图所示.下列说法错误的是( )
杨树生长迅速,高大挺拔,树冠有昂扬之势.其体内有一种有机物,结构如图所示.下列说法错误的是( )| A. | 该有机物属于烃的衍生物 | |
| B. | 分子式为C14H14O2 | |
| C. | 1 mol该物质与溴水反应时最多能消耗2 mol的Br2 | |
| D. | 该有机物能与Na2CO3溶液反应,且生成的气体能使澄清石灰水变浑浊 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com