
| A. | 等于5s | B. | 等于10s | C. | 小于10s | D. | 大于10s |
分析 随着反应物浓度的减小,化学反应速率减慢,反应所需时间增多,依此解答.
解答 解:N2O4的浓度由0.1mol•L-1降到0.07mol•L-1需要15s,即N2O4的浓度变化为0.1-0.07=0.03mol•L-1,
N2O4的浓度由0.07mol•L-1降到0.05mol•L-1,即N2O4的浓度变化为0.07-0.05=0.02mol•L-1,若反应速率不变,则所需时间为$\frac{0.02}{0.03}$=10s,但随着浓度的减小,反应速率逐渐减小,故所需时间大于10s,
故选D.
点评 本题考查浓度对化学反应速率的影响,难度不大,明确随着反应物浓度的减小,化学反应速率减慢,反应所需时间增多是解题的关键.


科目:高中化学 来源: 题型:解答题
| 物 质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| 溶度积/25℃ | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH范围 | ≥9.6 | ≥6.4 | 3~4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的熔点沸点依次升高 | |
| B. | 氯的各种含氧酸的酸性由强到弱排列为HClO4<HClO3<HClO2<HClO | |
| C. | 元素的性质呈现周期性变化的根本原因是元素原子的核外电子排布呈周期性变化 | |
| D. | 稀有气体一般难于发生化学反应,是由于其键能大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | 操作现象 |
| i | 取少量固体样品,加入过量稀盐酸,固体溶解,产生气体(经检验为H2),溶液呈浅黄色 |
| ii | 向i所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液,产生无色气体(经检验为O2,溶液变为深红色) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 该反应可能为可逆反应 | |
| B. | 该反应可表示为2AB2?2AB3 | |
| C. | 单位时间内生成1 mol B2的同时生成2 mol AB2,这表明该反应已达平衡 | |
| D. | 该过程中,已反应的AB2占AB2总数的$\frac{2}{3}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IV A | V A | VI A | VII A | O |
| 一 | A | |||||||
| 二 | B | C | ||||||
| 三 | D | E | F | G | H | I | ||
| 四 | K | J | ||||||
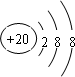 .
.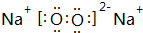 ,它属于离子(离子或共价)化合物.
,它属于离子(离子或共价)化合物.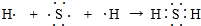 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+2H2O→CH4+2O2 | B. | NaOH+HCl=NaCl+H2O | ||
| C. | Cu+2HCl=Cu Cl2+H2↑ | D. | 4Al+3O2+6H2O=4Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
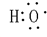 ;C22-(电子式)
;C22-(电子式) ;1,3-丁二烯(实验式)C2H3.
;1,3-丁二烯(实验式)C2H3.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com