
①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+K2SO4+7H2O
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4
下列结论正确的是()
A. ①②③均是氧化还原反应
B. 氧化性强弱顺序是K2Cr2O7>Fe2(SO4)3>I2
C. 反应②中氧化剂与还原剂的物质的量之比为6:1
D. 反应③中0.1mol还原剂共失去电子数为6.02×1023
考点: 氧化还原反应.
专题: 氧化还原反应专题.
分析: ①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,该反应中元素的化合价不变,不属于氧化还原反应;
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,Cr元素的化合价降低,Fe元素的化合价升高,为氧化还原反应;
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4中,Fe元素的化合价降低,I元素的化合价升高,为氧化还原反应,结合化合价变化及氧化剂的氧化性大于氧化产物的氧化物来解答.
解答: 解:①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,该反应中元素的化合价不变,不属于氧化还原反应;
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,Cr元素的化合价降低,Fe元素的化合价升高,为氧化还原反应;
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4中,Fe元素的化合价降低,I元素的化合价升高,为氧化还原反应,
A.②③属于氧化还原反应,而①不属于氧化还原反应,故A错误;
B.由②③中氧化剂的氧化性大于氧化产物的氧化性可知,氧化性强弱顺序是:K2Cr2O7>Fe2(SO4)3>I2,故B正确;
C.②中氧化剂为K2Cr2O7,还原剂为FeSO4,氧化剂与还原剂的物质的量之比为1:6,故C错误;
D.③中还原剂为HI,1molHI反应失去1mol电子,则0.1mol还原剂共失去电子数为6.02×1022,故D错误;
故选B.
点评: 本题考查氧化还原反应及电子转移的有关计算,为2015届高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应中转移电子及计算的考查,题目难度不大.


科目:高中化学 来源: 题型:
I.下列物质中属于强电解质的是 ;属于弱电解质的是 ;属于非电解质的是 .(填序号) ①氨气 ②氨水 ③盐酸 ④醋酸 ⑤硫酸钡 ⑥银 ⑦氯化钠 ⑧二氧化碳 ⑨醋酸铵 ⑩氢气
II.某反应体系中的物质有:Cr2(SO4)3、K2S2O8、K2Cr2O7、K2SO4、H2SO4、H2O.已知K2S2O8的氧化性比K2Cr2O7强.
(1)请将以上反应物与生成物编写成一个氧化还原反应方程式(不要求配平)
(2)反应中,被还原的物质是 是
(3)在酸性条件下K2Cr2O7与草酸(H2C2O4)反应的产物是:Cr2(SO4)3、CO2、K2SO4和H2O,则还原剂与氧化剂物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
①标准状况下,22.4L己烯含有的分子数为NA
②标准状况下,22.4L氧气和氮气的混合物含有的分子数约为NA
③7.1g氯气与足量的氢氧化钠溶液反应转移的电子数约为0.2NA
④1mol氨气中含有的共价键数约为4NA
⑤500mL1mol/L的硫酸铝溶液中含有的硫酸根离子数约为1.5NA.
A. ①④ B. ②⑤ C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
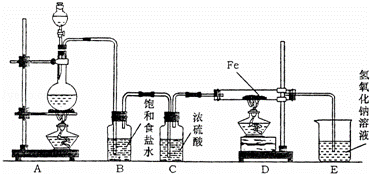
某研究性学习小组设计如图装置制取氯气并以氯气为原料进行实验.
(1)装置A烧瓶中发生反应的化学方程式为 ;
(2)装置B中饱和食盐水的作用是 ,装置C中浓硫酸的作用是 ;
(3)实验时,先点燃A处的酒精灯,再点燃D处酒精灯,写出D中反应的化学方程式 ,写出E中反应的离子方程式 ;
(4)若实验中用12mol•L﹣1浓盐酸10mL与足量的MnO2反应,生成Cl2的物质的量总是小于0.03mol,试分析可能存在的原因是:① ,② .
欲使反应生成Cl2的物质的量最大程度的接近0.03mol,则在装置气密性良好的前提下实验中应采取的措施是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语使用正确的是()
A. 次氯酸的结构式:H﹣Cl﹣O B. CO2的比例模型 
C. 甲基的电子式: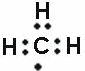 D. 漂粉精的主要成分:CaCl2
D. 漂粉精的主要成分:CaCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
利用下列装置进行相应实验,不能达到实验目的是()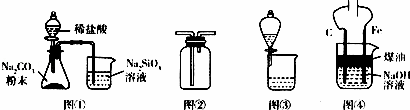
A. 图①装置可验证酸性:H2CO3>H2SiO3
B. 图②装置可用于收集气体H2、CO2、Cl2、NH3
C. 图③装置可用于分离互不相溶的两种液体
D. 图④装置可制备Fe(OH)2并能较长时间保持其颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,pH=5的NH4Cl溶液中,由水电离出的OH﹣浓度是()
A. 1×10﹣5mol/L B. 1×10﹣7mol/L C. 1×10﹣9mol/L D. 1×10﹣14mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
配制250ml 0.10mol/L的NaOH溶液时,下列实验操作会使得配制的溶液浓度偏大的是( )
|
| A. | 转移溶液后,未洗涤烧杯和玻璃棒就直接定容 |
|
| B. | 在容量瓶中进行定容时,仰视刻度线 |
|
| C. | 在容量瓶中进行定容时,俯视刻度线 |
|
| D. | 定容且把容量瓶倒置摇匀后,发现液面下降,又补充了水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2006年4月30日出现的亮菌甲素注射液引起多人中毒死亡的恶性事件.假药生产中原辅料中应有的“丙二醇”被换成廉价而有毒的化工原料“二甘醇”是致病人死亡的重要原因.二甘醇的结构简式是HO﹣CH2CH2﹣O﹣CH2CH2﹣OH.下列有关二甘醇的叙述正确的是()
A. 不能与金属钠发生反应 B. 能发生取代反应
C. 能溶于水,不溶于乙醇 D. 符合通式CnH2nO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com