
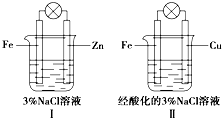
| A. | Ⅰ和Ⅱ中正极均被保护 | |
| B. | Ⅰ和Ⅱ中负极反应均是Fe-2e-═Fe2+ | |
| C. | Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-═4OH- | |
| D. | Ⅰ和Ⅱ中灯泡均会发亮 |
分析 锌比铁活泼,装置Ⅰ中锌做负极,负极反应为:Zn-2e-=Zn2+,铁做正极,溶液呈中性,发生吸氧腐蚀,正极反应为:O2+2H2O+4e-=4OH-;
装置Ⅱ中Zn为负极,电解质溶液呈酸性,所以正极的反应式为2H++2e-=H2↑,负极反应式为:Zn-2e-=Zn2+,以此解答该题.
解答 解:A.题给装置I、II都是原电池,活泼金属作负极,首先被腐蚀,不活泼金属作正极,被保护,故A正确;
B.Ⅰ中锌为负极Zn-2e-=Zn2+,Ⅱ中铁为负极Fe-2e-=Fe2+,故B错误;
C.I溶液显中性,发生吸氧腐蚀,正极电极反应式为:O2+2H2O+4e-=4OH-,Ⅱ溶液显酸性,正极电极反应式为:2H++2e-=H2↑□,故C错误;
D.Ⅰ和Ⅱ中都会构成原电池,有电流产生,灯泡发亮,故D正确.
故选AD.
点评 本题考查了原电池原理的分析判断,为高频考点,侧重于学生的分析能力的考查,注意电解质溶液不同,电极与电极反应变化,题目难度中等.


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | M<N | B. | 2M=N | C. | N<M | D. | M=N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
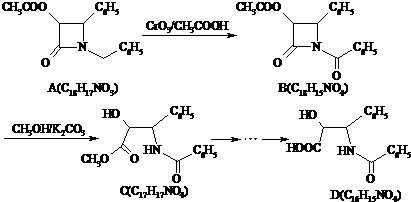
 .
.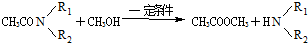
 或
或 ;
;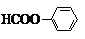 或
或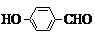 .
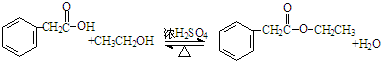
.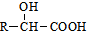 ②R′COOH$\stackrel{PCI_{3}}{→}$R′COCl
②R′COOH$\stackrel{PCI_{3}}{→}$R′COCl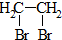
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
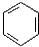 +CH3CO+HBr$\stackrel{ZnCI_{2}}{→}$
+CH3CO+HBr$\stackrel{ZnCI_{2}}{→}$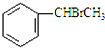 +H2O(卤烷基化反应)
+H2O(卤烷基化反应) +R′-X$\stackrel{一定条件}{→}$
+R′-X$\stackrel{一定条件}{→}$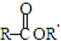 +NaX
+NaX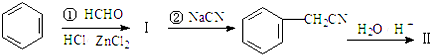 $\stackrel{NaOH}{→}$Ⅲ$\stackrel{一定条件}{→}$Ⅳ(C15H14O2)
$\stackrel{NaOH}{→}$Ⅲ$\stackrel{一定条件}{→}$Ⅳ(C15H14O2)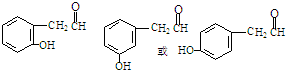 .
.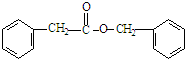 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
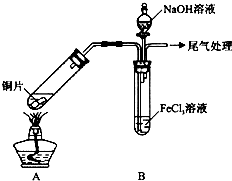
| 步骤② | 往5mL1mol•L-1 FeCl3溶液中通入SO2气体,溶液立即变为红棕色.微热3min,溶液颜色变为浅绿色. |
| 步骤③ | 往5mL重新配制的1mol•L-1 FeCl3溶液(用浓盐酸酸化)中通入SO2气体,溶液立即变为红棕色.几分钟后,发现溶液颜色变成浅绿色. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl原子的结构示意图: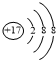 | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | NH4Cl的电子式: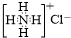 | D. | 间硝基甲苯的结构简式: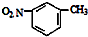 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com