
分析 在Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中,Cu元素化合价升高,失电子被氧化,S元素化合价降低,得电子被还原,以此解答该题.
解答 解:在Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中,Cu元素化合价升高,失电子被氧化,S元素化合价降低,转移电子总数为2,氧化剂是H2SO4,还原剂是Cu,氧化产物是CuSO4,还原产物是SO2,
故答案为:H2SO4;Cu;CuSO4;2e-.
点评 本题考查氧化还原反应知识,侧重于学生的分析能力和基本概念的理解和应用的考查,注意把握元素化合价的变化,为解答该题的关键,注意电子的转移方向和数目,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羟基的电子式: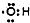 | |
| B. | 苯的分子式: | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 甲烷分子的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往硫化氢水溶液中加碱有利于S2-的增加 | |
| B. | 加入催化剂有利于氨氧化的反应 | |
| C. | 高压不利于合成氨的反应 | |
| D. | 500℃左右比室温更有利于合成氨的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 甲 | 乙 | 丙 |
| 元素符号 | ① | ② | O |
| 原子结构 示意图 | 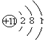 | ③ | ④ |
| 周期 | 三 | 三 | ⑤ |
| 族 | ⑥ | ⅦA | ⑦ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向CaCl2溶液中通入CO2至过量 | |
| B. | 向AlCl3溶液中滴加氨水溶液至过量 | |
| C. | 向氢氧化铁胶体中滴加稀硫酸至过量 | |
| D. | 向Na2SiO3溶液中滴加盐酸至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使酚酞变红的溶液:K+、Na+、NO3-、Cl- | |
| B. | 滴入少量KSCN溶液显红色的溶液中:Na+、K+、I-、SO42- | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1×1014的溶液:Ca2+、Na+、CH3COO-、NO3- | |
| D. | 由水电离的c(H+)=1×10-12 mol•L-1的溶液中:Ba2+、K+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24 L | B. | 1.12 L | C. | 0.672 L | D. | 0.448 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 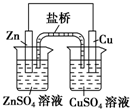 装置中,盐桥(含琼脂的饱和KCl溶液)中的K+移向ZnSO4溶液 | |
| B. | 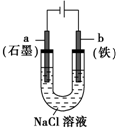 装置通电一段时间后溶液中有红褐色物质产生 | |
| C. | 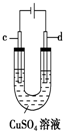 用装置精炼铜时,c极为粗铜 | |
| D. | 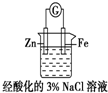 装置中电子由Zn电极沿外电路流向Fe电极,装置中有Fe2+生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com