
一定温度下,有a.盐酸、b.硫酸、c.醋酸三种酸:
①当其物质的量浓度相同时,c(H+)由大到小的顺序是______________________。
②等体积、等物质的量浓度的三种酸溶液,中和NaOH的能力由大到小的顺序是_______。
③当c(H+)相同时,物质的量浓度由大到小的顺序为_______________________。
④当c(H+)相同、体积相同时,分别加入足量锌,相同状况下产生的气体体积由大到小的顺序为________________。
⑤当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的氢气(相同状况)则开始时反应速率的大小关系是___________,反应所需时间的长短关系是_______________。
⑥将c(H+)相同的三种酸溶液均加水稀释至体积为原来的10倍后,c(H+)由大到小的顺序为____________________。
①b>a>c ②b>a=c ③c>a>b ④c>a=b ⑤a=b=c;a=b>c ⑥a=b<c
盐酸、硫酸、醋酸三种溶液中有下列异同点:
CH3COOH是一元弱酸,在水溶液中的电离为不完全电离,存在电离平衡:
CH3COOH![]() CH3COO-+H+
CH3COO-+H+
K(CH3COOH)在25 ℃时仅为1.8×10-5,CH3COOH在溶液中只有极少数电离为CH3COO-和H+;当其他条件一定,c(H+)减小时,电离平衡会向着生成CH3COO-和H+的方向移动。
HCl也是一元酸,但它是强酸,在水溶液中的电离为完全电离,无电离平衡。HCl的电离方程式为:HCl====H++Cl-
H2SO4是强酸,但它是二元强酸,在水溶液中的电离也为完全电离,无电离平衡。H2SO4的电离方程式为:H2SO4====2H++![]()
①设三种酸的物质的量浓度均为x。盐酸中c(H+)=c(HCl)=x,硫酸中c(H+)=2×c(H2SO4)=2x,醋酸中c(H+)<<c(CH3COOH),c(H+)<<x。
②“中和NaOH的能力”,含义是被一定物质的量的酸中和的NaOH的物质的量。被中和的NaOH的物质的量大(或小),则酸中和NaOH的能力就大(或小)。由于三种酸溶液同体积、同物质的量浓度,所以三种酸等物质的量。由
H2SO4+2NaOH====Na2SO4+2H2O
1 mol 2 mol
HCl+NaOH====NaCl+H2O
1 mol 1 mol
CH3COOH+NaOH====CH3COONa+H2O
1 mol 1 mol
可知,H2SO4中和NaOH的能力最大,HCl与CH3COOH中和NaOH的能力相同且较小。
③由“①”的解析可知,c(H+)相同时,c(CH3COOH)最大,c(HCl)次之, c(H2SO4)最小。
④锌足量,生成氢气的体积大小,决定于可被还原的H+的总物质的量(包括已电离出的和尚未电离出的)。三种酸溶液自由移动的c(H+)相同、体积相同,则自由移动的n(H+)相同。HCl、H2SO4均为强酸,在溶液中完全电离,两酸溶液中可被还原的H+全为自由移动状态而无后备者。CH3COOH为弱酸,在溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,还有较多的CH3COOH尚未电离,当c(H+)减小后,CH3COOH的电离平衡就向生成H+的方向移动。在醋酸溶液中可被还原的H+,除已电离为自由移动状态、与其他酸中物质的量相同者以外,还有许多后备者。
CH3COO-+H+,还有较多的CH3COOH尚未电离,当c(H+)减小后,CH3COOH的电离平衡就向生成H+的方向移动。在醋酸溶液中可被还原的H+,除已电离为自由移动状态、与其他酸中物质的量相同者以外,还有许多后备者。
⑤反应开始时,反应物的一方——H+的浓度相同,反应物的另一方——Zn的形状、密度、质量也相同,由影响化学反应速率的因素及影响规律可知,开始时各反应的反应速率相同。
由于HCl、H2SO4的电离都是完全电离,CH3COOH的电离是处于动态平衡状态,反应开始后盐酸、硫酸中H+数目有减无增,CH3COOH的电离平衡向生成H+的方向移动,使H+数目有减也有增,故反应开始后盐酸、硫酸中的反应速率下降程度相同且下降得较快,醋酸中的反应速率下降得较慢。即盐酸与硫酸中反应速率相同且比醋酸中的反应速率低。生成同体积的氢气时,盐酸、硫酸中的反应所需时间相同且较长,醋酸中的反应所需要的时间较短。
⑥由于HCl、H2SO4的电离都是完全电离,酸中可电离的氢都已完全电离出来,加水稀释后H+数目不变;CH3COOH的电离为不完全电离,酸中可电离的氢还有一大部分没有电离出来。加水稀释后CH3COOH的电离平衡向生成H+的方向移动,使H+数目增大。所以,加水稀释至体积为原来的10倍以后,盐酸、硫酸中c(H+)相同且下降程度较大,醋酸中c(H+)下降程度较小。


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:



| 1 | 18 |
查看答案和解析>>
科目:高中化学 来源: 题型:
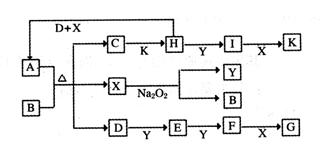
如下图的转化关系中,已知A是由短周期元素组成的酸式盐。D、Y、H为气体,X为无色液体,G和K均是常见的强酸。H与Na2O2可发生化合反应![]() ,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。
,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。
试回答下列问题:

(1)D的电子式为:___________________;
(2)写出D+H+X→A的化学方程式:________;
(3)写出C→H的离子方程式:_______________;
(4)写出D与K反应生成的正盐溶液中的离子浓度大小关系:____________________;
(5)已知1molH(g)完全转化为I(g)时放热98.3kJ,则此反应的热化学方程式为_________;
某条件下,当加入4 mol H和2 mol Y后,放出314.56 kJ的热时,此时H的转化率为__________;
(6)一定温度下,有可逆反应:aD(g)+bY(g)![]() cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)
如下图的转化关系中,已知A是由短周期元素组成的酸式盐。D、Y、H为气体,X为无色液体,G和K均是常见的强酸。H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。
试回答下列问题:
(1)D的电子式为:___________________;
(2)写出D+H+X→A的化学方程式:________;
(3)写出C→H的离子方程式:_______________;
(4)写出D与K反应生成的正盐溶液中的离子浓度大小关系:____________________;
(5)已知1molH(g)完全转化为I(g)时放热98.3kJ,则此反应的热化学方程式为_________;
某条件下,当加入4 mol H和2 mol Y后,放出314.56 kJ的热时,此时H的转化率为__________;
(6)一定温度下,有可逆反应:aD(g)+bY(g)cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年黑龙江省大庆市高三期中考试化学试卷(解析版) 题型:填空题
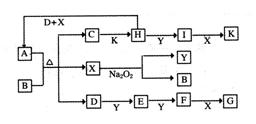
(16分)如下图的转化关系中,已知A是由短周期元素组成的酸式盐。D、Y、H为气体,X为无色液体,G和K均是常见的强酸。H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。
试回答下列问题:
(1)D的电子式为:___________________;
(2)写出D+H+X→A的化学方程式:________________________________;
(3)写出C→H的离子方程式:_______________________________;
(4)写出D与K反应生成的正盐的化学式:_____________;
(5)已知1molH(g)完全转化为I(g)时放热98.3kJ,则此反应的热化学方程式为____________________________;某条件下,当加入4 mol H和2 mol Y后,放出314.56 kJ的热时,此时H的转化率为__________;
(6)一定温度下,有可逆反应:aD(g)+bY(g) cE(g)+dX(g)。在2 L密闭容器中,充入4 mol
D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
cE(g)+dX(g)。在2 L密闭容器中,充入4 mol
D和5 mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源:黑龙江省哈尔滨市2010届高三一模(理科综合)化学部分 题型:填空题
(16分)
如下图的转化关系中,已知A是由短周期元素组成的酸式盐。D、Y、H为气体,X为无色液体,G和K均是常见的强酸。H与Na2O2可发生化合反应,生成的盐与Ba2+反应可生成不溶于稀G的白色沉淀,一个D分子中含有10个电子。
试回答下列问题:
(1)D的电子式为:___________________;
(2)写出D+H+X→A的化学方程式:________;
(3)写出C→H的离子方程式:_______________;
(4)写出D与K反应生成的正盐溶液中的离子浓度大小关系:____________________;
(5)已知1molH(g)完全转化为I(g)时放热98.3kJ,则此反应的热化学方程式为_________;
某条件下,当加入4 mol H和2 mol Y后,放出314.56 kJ的热时,此时H的转化率为__________;
(6)一定温度下,有可逆反应:aD(g)+bY(g) cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5
mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
cE(g)+dX(g)。在2 L密闭容器中,充入4 mol D和5
mol Y,有催化剂存在下,2 min后反应达到平衡,测得平衡时容器内的压强比反应前增加了1/18。则前2 min内用E表示的平均反应速率为______mol·L-1·min-1,平衡时D的浓度为________mol·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com