
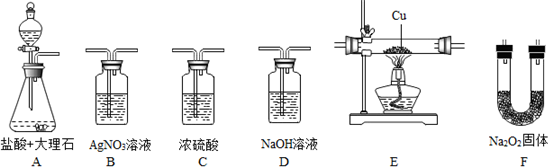
分析 要证明二氧化碳能跟过氧化钠反应制取氧气,只要将氧气通过E装置与铜反应生成黑色的氧化铜,就能判读.A中是大理石和盐酸反应得到二氧化碳气体,由于盐酸有挥发性,得到的二氧化碳中含有氯化氢和水蒸气,通过B装置即硝酸银溶液除去氯化氢气体,再通过C装置即浓硫酸干燥二氧化碳,将纯净的二氧化碳通入F与过氧化钠反应得到氧气,最后将氧气通入E装置,观察现象,得出结论.
解答 解:要证明二氧化碳能跟过氧化钠反应制取氧气,需将氧气通过E装置与铜反应生成黑色的氧化铜来判断.A中是大理石和盐酸反应得到二氧化碳气体,由于盐酸有挥发性,得到的二氧化碳中含有氯化氢和水蒸气,通过B装置即硝酸银溶液除去氯化氢气体,再通过C装置即浓硫酸干燥二氧化碳,将纯净的二氧化碳通入F与过氧化钠反应得到氧气,最后将氧气通入E装置,发生化合反应:Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO,E中红色金属铜变成黑色,证明二氧化碳能跟过氧化钠反应制取氧气,
故答案为:ABCFE;吸水、干燥二氧化碳;E中红色金属铜变成黑色;Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO.
点评 本题考查二氧化碳气体的制备和净化,碱金属的性质只是以信息的形式出现,掌握化学基础知识就能解答,题目非常简单.


科目:高中化学 来源: 题型:实验题
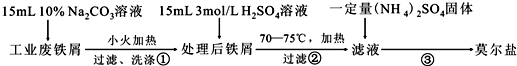
 案.
案.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.3mol/(L•s) | B. | v(B)=0.6mol/(L•s) | C. | v(C)=0.4mol/(L•s) | D. | v(D)=0.45mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y分别与Z、W形成的化合物中化学键类型不相同 | |
| B. | 单质的沸点:Y>Z | |
| C. | X、Y、Z三种元素不可能形成离子化合物 | |
| D. | X的最高价氧化物对应的水化物的酸性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫气体通入硝酸钡溶液,生成白色BaSO4沉淀 | |
| B. | 氨气的水溶液可以导电,所以氨气是电解质 | |
| C. | 酸性高锰酸钾溶液中通入二氧化硫气体,溶液褪色,证明二氧化硫有漂白性 | |
| D. | 硝酸具有挥发性,所以硝酸不稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
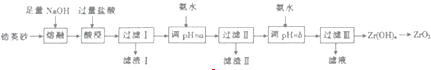
| 离子 | Fe3+ | AP+ | ZrO2+ |
| 开始沉淀pH | 1.9 | 3.3 | 6.2 |
| 完仝沉淀pH | 3.2 | 5.2 | 8.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com