
| A. | 所用HNO3为浓度为10mol/L | B. | NO的体积为6.72升 | ||
| C. | NO2的体积为3.36升 | D. | 被还原的HNO3为1mol |
分析 计算NO和NO2的总物质的量,根据二者总物质的量、电子转移守恒列方程计算各自物质的量,再根据V=nVm各自体积,被还原的硝酸生成NO和NO2,根据N原子守恒计算被还原HNO3的物质的量,根据N元素守恒计算HNO3的总物质的量,进而计算硝酸浓度.
解答 解:32g铜的物质的量为$\frac{32g}{64g/mol}$=0.5mol,在反应中失去的电子的物质的量为2×0.5mol=1mol,11.2L混合气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,
令NO和NO2的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=0.5}\\{3x+y=1}\end{array}\right.$
解得x=0.25,y=0.25,
A.由N原子守恒,n(HNO3)=2n[Cu(NO3)2]+n(NO)+n(NO2)=0.5mol×2+0.5mol=1.5mol,故所用HNO3为浓度为$\frac{1.5mol}{0.15L}$=10mol/L,故A正确;
B.V(NO)=0.25mol×22.4L/mol=5.6L,故B错误;
C.V(NO2)=0.25mol×22.4L/mol=5.6L,故C错误;
D.被还原的硝酸生成NO和NO2,根据N原子守恒,被还原HNO3的物质的量为0.5mol,故D错误,
故选:A.
点评 本题考查化学方程式计算,难度中等,注意利用电子转移守恒进行解答,避免利用方程式计算的繁琐.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na2O2晶体中含有的阴离子数目为2NA | |
| B. | 1 mol Na2O2与足量CO2反应时,转移2NA个电子 | |
| C. | 1 mol•L-1的NaOH溶液中含Na+数目为NA | |
| D. | 1 mol钠与足量氧气反应生成Na2O或Na2O2时,失电子数目均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol乙酸在浓H2SO4存在下与足量乙醇反应可得1 mol乙酸乙酯 | |
| B. | 对苯二甲酸(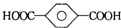 ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 ( ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 (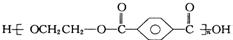 ) ) | |
| C. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. |  分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
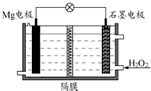 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液(加入一定量酸),示意图如图.该电池工作时,下列说法正确的是( )
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液(加入一定量酸),示意图如图.该电池工作时,下列说法正确的是( )| A. | 电池工作时,石墨周围海水的pH减少 | |
| B. | 电池工作时,溶液中的H+向负极移动 | |
| C. | 电池总反应为Mg+H2O2+2H+═Mg2++2H2O | |
| D. | Mg电极是该电池的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学研究性学习小组探究Fe3+和SO32-之间发生的反应.
某化学研究性学习小组探究Fe3+和SO32-之间发生的反应.| 操作 | 现象及结论 |
| 基于方案一: | |
| 基于方案二: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、NO3-、MnO4- | B. | OH-、Ba2+、Cl-、SO42- | ||
| C. | HCO3-、K+、OH-、NO3- | D. | NO3-、SO42-、K+、Mg2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com