
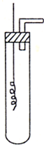
 某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如下图所示的实验装置.请你根据他们的思路,选择下列药品完成实验,填写实验步骤并回答问题.供选择的药品:铜丝、稀硝酸、烧碱溶液、铁粉、CaCO3颗粒.
某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如下图所示的实验装置.请你根据他们的思路,选择下列药品完成实验,填写实验步骤并回答问题.供选择的药品:铜丝、稀硝酸、烧碱溶液、铁粉、CaCO3颗粒.分析 (1)对于气体的制备,组装完装置,需检查气密性;
(2)一氧化氮易与空气中氧气反应,故制取一氧化氮之前,应先排净装置中空气,可用碳酸钙和硝酸反应产生的二氧化碳来排净空气;
(4)Cu与稀硝酸反应生成硝酸铜、NO和水;
(5)NO与氧气反应生成红棕色气体二氧化氮.
解答 解:(1)该反应制备气体,则实验开始时,必须进行的第一步操作是检验装置的气密性,
故答案为:气密性;
(2)一氧化氮易与空气中氧气反应,故制取一氧化氮之前,应先排净装置中空气,可用碳酸钙和硝酸反应产生的二氧化碳来排净空气,防止与NO反应,
故答案为:CaCO3颗粒,排出试管中的空气,防止与NO反应;
(4)铜与稀硝酸反应生成硝酸铜、NO和水,化学反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(5)NO与氧气反应生成二氧化氮,则向试管内推入空气,现象是气体由无色变红棕色,2NO+O2=2NO2,
故答案为:气体由无色变红棕色.
点评 本题以硝酸的性质为载体综合考查性质实验的设计,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握相关物质的性质,明确实验目的和原理是解答该题的关键,注意相关实验操作方法的注意事项,题目难度中等.


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol•L-1 | |
| B. | 18gH2O在标准状况下的体积是22.4L | |
| C. | 22.4LO2中一定含有6.02×1023个氧分子 | |
| D. | 在标准状况时,20mLNH3与60mLNO所含的原子个数比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1H2C2O4溶液 | 水 | 1mol•L-1MnSO4溶液 | 反应温度/℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0 | 0 | 20 | 125 |
| Ⅱ | 2mL | 1mL | 1mL | 0 | 20 | 320 |
| Ⅲ | 2mL | 2mL | mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0 | 2滴 | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| HI体积分数 | 1min | 2min | 3min | 4min | 5min | 6min | 7min |
| 条件I | 26% | 42% | 52% | 57% | 60% | 60% | 60% |
| 条件II | 20% | 33% | 43% | 52% | 57% | 65% | 65% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 方法Ⅰ | 用氨水将SO2转化为(NH4)2SO3、(NH4)2SO4 |
| 方法Ⅱ | 用生石灰吸收SO2,再转化为CaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
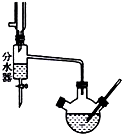 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com