(2010?崇文区一模)如图1为某套实验装置示意图,其中加热装置和部分药品等已经省略(装置①和装置②为气体发生装置).
(1)甲同学利用如图1所示装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO
2并验证其性质.装置①用于实验室制备NH
3,用装置②制备过量O
2.A装置中相应药品在催化加热时发生反应的化学方程式是
.B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,请解释原因
因为2NO+O2=2NO2,2NO2(红棕)?N2O4(无色),正反应是放热反应,U型管底部的温度降低,上述平衡向右移动,NO2浓度降低,颜色变浅
因为2NO+O2=2NO2,2NO2(红棕)?N2O4(无色),正反应是放热反应,U型管底部的温度降低,上述平衡向右移动,NO2浓度降低,颜色变浅
.
(2)乙同学利用图2所示装置合成SO
3,B处冰水冷却的U型管中的固体出现.C中若盛放K
2Cr
2O
7溶液,则在C中发生的氧化还原反应的离子方程式是
Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O
Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O
(生成物中Cr以Cr
3+形式存在);现欲制得纯净干燥的SO
3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进
将e、m依次连接在B、C之间或将C装置换成f
将e、m依次连接在B、C之间或将C装置换成f
(从下面给出的实验装置中选择字母标号补充或替换,并用简要文字说明)
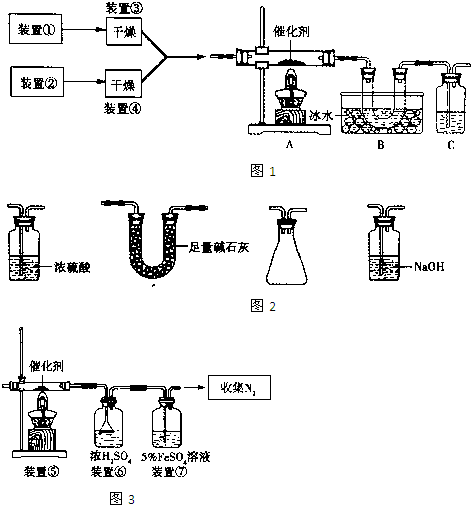
(3)丙同学采用图3所示装置拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH
3),将上述装置A、B、C分别换成下列⑤、⑥、⑦.
请回答:装置⑦的作用可能是
吸收未反应的NO
吸收未反应的NO
;若进入装置⑤的NO共2688mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下2016ml N
2,则NO的转化率是
(能正确表达出计算过程即可)



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案