
| A. | 已知H2的燃烧热△H=-285.8 kJ•mol-1,则用热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ•mol-1 | |
| B. | 稀硫酸和Ba(OH)2溶液的反应:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| C. | NH4HCO3溶液与足量NaOH溶液共热:NH4++H++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O | |
| D. | 用足量KMnO4溶液吸收SO2气体:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+ |
分析 A.燃烧热生成物质为稳定的氧化物;
B.离子个数配比不符合物质结构组成;
C.氢氧化钠足量,铵根离子、碳酸氢根离子都反应;
D.二者发生氧化还原反应,生成硫酸根离子、二价锰离子和水.
解答 解:A.氢气燃烧生成液体水稳定,而H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1,故A错误;
B.稀硫酸和Ba(OH)2溶液的反应,离子方程式:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故B错误;
C.NH4HCO3溶液与足量NaOH溶液共热,离子方程式:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+2H2O+CO32-,故C错误;
D.用足量KMnO4溶液吸收SO2气体,离子方程式:2MnO4-+5SO2+2H2O═2Mn2++5SO42-+4H+,故D正确;
故选:D.
点评 本题考查离子反应及化学反应的书写,为高频考点,把握发生的化学反应为解答的关键,侧重考查复分解反应、氧化还原反应离子方程式书写,注意燃烧热的概念,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:选择题
以下是对某水溶液进行离子检验的方法和结论,其中正确的是
A.先加入BaCl2溶液,再加入足量HNO3溶液,产生白色沉淀,溶液中一定含有大量SO42-
B.加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定含有大量的CO32-
C.加入足量浓 NaOH溶液,产生带有强烈刺激性气味的气体,溶液中一定含有大量NH4+
D.先加适量盐酸将溶液酸化,再加AgNO3溶液,产生白色沉淀,溶液中一定含有大量Cl-
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:选择题
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
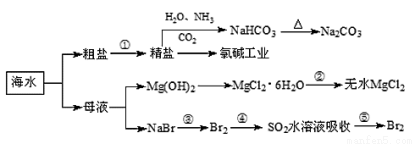
下列有关说法正确的是( )
A.在第③、④、⑤步骤中,溴元素均被氧化
B.制取NaHCO3的反应是利用其在此反应所涉及物质中溶解度最小
C.用澄清的石灰水可鉴别NaHCO3和Na2CO3
D.工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 序号 | 反应温度 (℃) | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑦ | B. | ③④⑥ | C. | ②④⑤ | D. | ②③⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
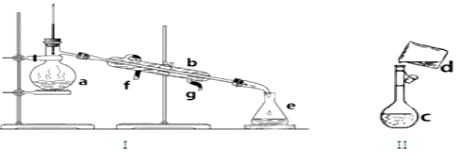
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

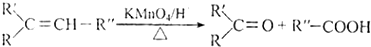
 .
. .
.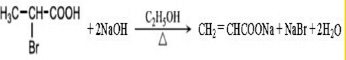 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡是放热反应都是自发的,凡是吸热反应都是非自发的 | |
| B. | 自发反应一定是放热反应,非自发反应一定是吸热反应 | |
| C. | 自发反应在恰当条件下才能实现 | |
| D. | 自发反应在任何条件下都能实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
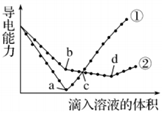
| A. | b点,水电离产生的c(H+)<10-7mol/L | B. | ①代表滴加H2SO4溶液的变化曲线 | ||
| C. | a、d两点对应的溶液均显中性 | D. | c点,两溶液中含有相同量的 OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com