
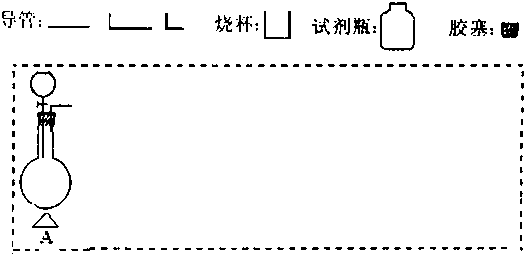
| 仪器符号 | 仪器中所加物质 | 作用 |
| A | MnO2、浓盐酸 | MnO2与浓盐酸生成Cl2 |
| ||
| ||
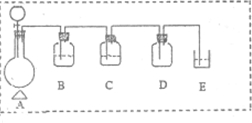
 ;
;| 仪器符号 | 仪器中所加物质 | 作用 |
| B | 饱和食盐水 | 除去Cl2中的HCl |
| C | 浓硫酸 | 除去Cl2中的H2O |
| D | 无 | 收集氯气 |
| E | NaOH溶液 | 尾气处理,防止环境污染 |
| 仪器符号 | 仪器中所加物质 | 作用 |
| B | 饱和食盐水 | 除去Cl2中的HCl |
| C | 浓硫酸 | 除去Cl2中的H2O |
| D | 无 | 收集氯气 |
| E | NaOH溶液 | 尾气处理,防止环境污染 |
| ||
| ||


科目:高中化学 来源: 题型:阅读理解
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 |
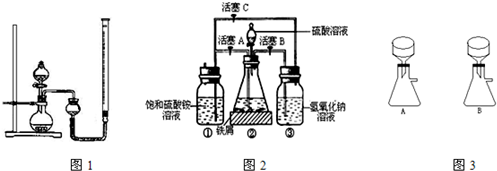
- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(12分)重铬酸钠Na2Cr2O7·2H2O俗称红矾钠,是一种重要的无机盐产品,可作氧化剂,在印染、颜料、电镀、医药等工业方面有广泛的用途。某化学兴趣小组设计实验测定市场上的红矾钠中Na2Cr2O7的质量分数,其步骤如下:
I.称取Wg红矾钠,溶于酸配成l00mL溶液;
Ⅱ.用cmol·L-1的标准KMnO4酸性溶液滴定20.00mL一定浓度的FeSO4溶液,消耗KMnO4溶液20.00rnL;
Ⅲ.取20.00mL Na2Cr2O7溶液,用上述FeSO4溶液滴定,达到滴定终点时,消耗24.00mLFeSO4溶液;
查阅资料知:Cr相对原子质量为52
Cr2O2-7具有强氧化性,在酸性条件下易被还原为Cr3+
回答下列问题:
(1)Na2Cr2O7与FeSO4的反应离子方程式为 .
(2)步骤Ⅱ中的滴定过程选用 (填“酸式”或“碱式”)滴定管。
(3)已知:MnO-4+5Fe2++8H+==Mn2++5Fe3++4H2O,此红矾钠中Na2Cr2O7的质量分数的表达式为 。
(4)判断下列操作对Na2Cr2O7的质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”):
①步骤Ⅲ中的滴定过程,滴定终点读数时俯视读数 ;
②配制c mol·L-1的KMnO4标准溶液时,转移时有少量溶液洒出 。
(5)有同学提出FeSO4有很强的还原性,在空气中易被氧化而变质,因此对测定结果会造成影响,请你分析后指出,如果FeSO4变质,对测定结果的影响是 (填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖南省高三第一周考试化学试卷(解析版) 题型:填空题
(18分)自2010年8月7日,甘肃省舟曲县发生特大泥石流后,各地的救援物资远远不断运往灾区。下图为地方捐助的一种国家准字号补铁补血用药——复方硫酸亚铁叶酸片,其主要成分是绿矾——硫酸亚铁晶体(FeSO4·7H2O)。
Ⅰ、某校课外活动小组为测定该补血剂中铁元素的含量特设计实验步骤如下:
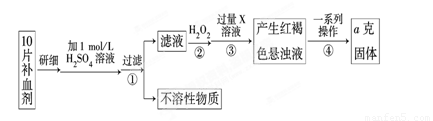
请回答下列问题:
(1)步骤②中加入过量H2O2的目的是 。
(2)步骤③中反应的离子方程式为 。
(3)步骤④中一系列处理的操作步骤是:过滤、 、灼烧、冷却、称量。
(4)若实验无损耗,则每片补血剂含铁元素的质量为 g(用含a的代数式表示)。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO+8H+===5Fe3++Mn2++4H2O)。某同学设计的下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号)。
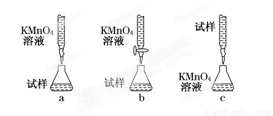
Ⅱ、灾难过后,灾区的饮用水变得非常的浑浊,不能饮用。因此对污染的饮用水的处理成了非常重要的事,其中处理的方法有很多:
(1)可以用适量绿矾和氯气一起作用于污染的自来水,而起到较好的净水效果;理由是(用离子方程式表示) 。
(2)在使用过程中发现绿矾和氯气的混合使用对酸性废水中的悬浮物处理效果较差,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省、临川一中高三8月联考化学试卷(解析版) 题型:实验题
(10分)自2010年8月7日,甘肃省舟曲县发生特大泥石流后,各地的救援物资远远不断运往灾区。下图为地方捐助的一种国家准字号补铁补血用药——复方硫酸亚铁叶酸片,其主要成分是绿矾——硫酸亚铁晶体(FeSO4·7H2O)。
Ⅰ、某校课外活动小组为测定该补血剂中铁元素的含量特设计实验步骤如下:
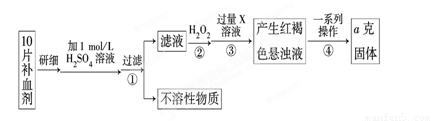
请回答下列问题:
(1)步骤②中加入过量H2O2的目的是 。
(2)步骤③中反应的离子方程式为 。
(3)步骤④中一系列处理的操作步骤是:过滤、 、灼烧、 、称量。
(4)若实验无损耗,则每片补血剂含铁元素的质量为 g(用含a的代数式表示)。
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定(5Fe2++MnO+8H+===5Fe3++Mn2++4H2O)。
某同学设计的下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号)。

Ⅱ、灾难过后,灾区的饮用水变得非常的浑浊,不能饮用。因此对污染的饮用水的处理成了非常重要的事,其中处理的方法有很多:
(1)可以用适量绿矾和氯气一起作用于污染的自来水,而起到较好的净水效果;理由是(用离子方程式表示) 。
(2)在使用过程中发现绿矾和氯气的混合使用对酸性废水中的悬浮物处理效果较差,其原因是 。
查看答案和解析>>
科目:高中化学 来源:2012届河北省高二下学期期中考试化学试卷 题型:实验题
(12分)重铬酸钠Na2Cr2O7·2H2O俗称红矾钠,是一种重要的无机盐产品,可作氧化剂,在印染、颜料、电镀、医药等工业方面有广泛的用途。某化学兴趣小组设计实验测定市场上的红矾钠中Na2Cr2O7的质量分数,其步骤如下:
I.称取Wg红矾钠,溶于酸配成l00mL溶液;
Ⅱ.用cmol·L-1的标准KMnO4酸性溶液滴定20.00mL一定浓度的FeSO4溶液,消耗KMnO4溶液20.00rnL;
Ⅲ.取20.00mL Na2Cr2O7溶液,用上述FeSO4溶液滴定,达到滴定终点时,消耗24.00mLFeSO4溶液;
查阅资料知:Cr相对原子质量为52
Cr2O2-7具有强氧化性,在酸性条件下易被还原为Cr3+
回答下列问题:
(1)Na2Cr2O7与FeSO4的反应离子方程式为 .
(2)步骤Ⅱ中的滴定过程选用 (填“酸式”或“碱式”)滴定管。
(3)已知:MnO-4+5Fe2++8H+==Mn2++5Fe3++4H2O,此红矾钠中Na2Cr2O7的质量分数的表达式为 。
(4)判断下列操作对Na2Cr2O7的质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”):
①步骤Ⅲ中的滴定过程,滴定终点读数时俯视读数 ;
②配制c mol·L-1的KMnO4标准溶液时,转移时有少量溶液洒出 。
(5)有同学提出FeSO4有很强的还原性,在空气中易被氧化而变质,因此对测定结果会造成影响,请你分析后指出,如果FeSO4变质,对测定结果的影响是 (填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com