

| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
分析 I(1)海水中的弱酸根离子水解显碱性;
(2)H2SO3或HSO3-中的S显+4价,均可被O2氧化生成H++SO42-,酸性会大大增强,氧化后的“海水”需要引入大量的显碱性的海水与之混合后才能排放,主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+);
II(3)溶度积越小越易转化为沉淀,根据表格中的数据进行判断最近试剂;
(4)先计算出溶液中氢氧根离子的物质的量浓度,然后根据Pb(OH)2的溶度积及c(Pb2+)=$\frac{Ksp}{{c}^{2}(O{H}^{-})}$进行计算;
(5)根据氯化银的溶度积进行解答;
解答 解:I(1)天然海水的pH≈8,是因为海水中有CO32-或HCO3-+它们水解使海水呈弱碱性,其离子方程式为CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-,
故答案为:CO32-+H2O?HCO3-+OH-或 HCO3-+H2O?H2CO3+OH-;
(2)H2SO3中的S显+4价,均可被O2氧化生成H2SO4,酸性会大大增强,氧化后的“海水”需要引入大量的显碱性的海水与之混合后才能排放,主要目的是中和、稀释经氧气氧化后海水中生成的酸(H+),
故答案为:2H2SO3+O2=2H2SO4;中和、稀释经氧气氧化后海水中生成的酸(H+);
II(3)溶度积越小的越易转化为沉淀,由表格中的数据可知,硫化物的溶度积小,则应选择硫化钠,
故答案为:B;
(4)由Pb(OH)2的溶度积为1.2×10-15,pH=8.0,c(OH-)=10-6mol•L-1,则c(Pb2+)=$\frac{Ksp}{{c}^{2}(O{H}^{-})}$=$\frac{1.2×1{0}^{-15}}{(1{0}^{-6})^{2}}$=1.2×10-3mol•L-1,
故答案为:1.2×10-3mol•L-1;
(5)废水中NaCl的质量分数为0.117%(ρ≈1g•mL-1),c(Cl-)=c(NaCl)=$\frac{1000×1g/ml×0.117%}{58.5g/mol}$=0.02mol/L,
Ksp(AgCl)=c(Ag+)•c(Cl-)=1.8×10-10mol2•L-2,则c(Ag+)=$\frac{1.8×1{0}^{-10}}{0.02}$=9×10-9mol•L-1,
故答案为:9×10-9mol•L-1;
点评 本题考查了含硫烟气的处理及难溶物的沉淀转化,利用所学知识结合框图信息是解答本题的关键,难度中等,注意把握Ksp的有关计算的方法.


科目:高中化学 来源: 题型:选择题
| A. | 常温下所有的金属都是固态 | |
| B. | 金属具有导电、导热和延展性 | |
| C. | 金属元素的原子只有还原性,离子只有氧化性 | |
| D. | 所有金属元素都以化合态存在于自然界 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16g氧气所含的氧原子数为2NA | |
| B. | 18g水所含的电子数为NA | |
| C. | 2.4g金属镁与盐酸(足量)反应失去的电子数为0.1NA | |
| D. | 17g氨气所含电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时可用水扑灭 | |
| B. | 酒精灯着火时用湿抹布扑盖 | |
| C. | 蒸发结晶时,为得到更多晶体直接将溶液蒸干 | |
| D. | 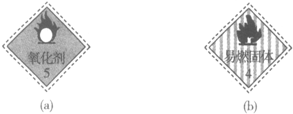 实验室可分别将贴有标志(a)和标志(b)的药品放在同一橱柜中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮肥NH4NO3在重力撞击下可能发生爆炸 | |
| B. | 在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮 | |
| C. | SO2可以用来漂白纸浆、毛、丝、草帽辫、增白食品等 | |
| D. | 碳酸氢钠可用来治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
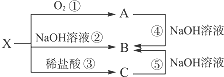 已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com