
【题目】某研究小组设计如下所示实验装置(夹持装置已略去)分别探究NO与铜粉、Na2O2的反应。

已知:①NO与Na2O2可发生反应2NO+Na2O2===2NaNO2。
②NO能被酸性高锰酸钾溶液氧化为NO3-
③在溶液中存在平衡FeSO4+NO![]() Fe(NO)SO4(棕色)
Fe(NO)SO4(棕色)
I.关闭K3,打开K2,探究NO与铜粉的反应并检验NO。
(1)反应开始前,打开K1,通入一段时间N2,其目的是______________________。
(2)装置B中盛放的试剂为水,其作用是______________________。
(3)装置F中的实验现象为___________。装置H中收集的气体为___________(填化学式)。
Ⅱ.关闭K2,打开K3,探究NO与Na2O2的反应并制备NaNO2。
(4)装置G的作用是______________________。
(5)若省略装置C,则进入装置G中的气体除N2、NO外,可能还有___________(填化学式)。
(6)测定反应后装置E中NaNO2的含量。已知;在酸性条件下,NO2-可将MnO4-还原为Mn2+,为测定样品中亚硝酸钠的含量,该小组同学称取ag样品溶于水配制成250mL溶液,取25.00mL所得溶液于锥形瓶中,用0.100mol·L-1的酸性KMnO4溶液滴定至终点时,消耗bmL酸性KMnO4溶液。
①滴定过程中发生反应的离子方程式为______________________。
②滴定过程中酸性KMnO4溶液的作用是___________。
③样品中NaNO2的质量分数为___________用含有a、b的代数式表示)
【答案】排尽装置中的空气,防止NO被空气中的氧气氧化为二氧化氮 吸收挥发出的硝酸 溶液由浅绿色变为棕色 NO、N2 吸收未参与反应的NO,防止污染空气 NO2和O2 5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O 作氧化剂和滴定剂 17.25b/a%
【解析】
(1)NO易与O2反应生成NO2,反应开始前,打开K1,通入一段时间N2,其自的是排尽装置中的空气,防止NO被空气中的氧气氧化为二氧化氮。
(2)硝酸易挥发,会随NO一起出来干扰后续的实验,所以装置B中盛放的试剂为水为了溶解挥发的硝酸。
(3)由于在溶液中存在平衡FeSO4+NO![]() Fe(NO)SO4(棕色),装置F中的实验现象为溶液由浅绿色变为棕色,D装置红色粉末变为黑色,NO和Cu发生了反应,生成CuO和N2,又因为NO是气体,不可能完全反应,故H收集的气体是一氧化氮和N2。
Fe(NO)SO4(棕色),装置F中的实验现象为溶液由浅绿色变为棕色,D装置红色粉末变为黑色,NO和Cu发生了反应,生成CuO和N2,又因为NO是气体,不可能完全反应,故H收集的气体是一氧化氮和N2。
(4)根据信息NO能与酸性高锰酸钾溶液反应,装置G的作用吸收未参与反应的NO,防止污染空气。
(5)C是干燥装置,若省略装置C,那么水蒸气会与Na2O2反应生成NaOH和O2,NO和O2反应生NO2,则进入装置G中的气体除N2、NO外,可能还有NO2和O2。
(6)①在酸性条件下,NO2-可将MnO4-还原为Mn2+,化学反应方程式:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O。
②滴定过程中酸性KMnO4溶液的作用即作为滴定反应的反应物,作氧化剂,自身也可作指示剂判断反应终点,当锥形瓶滴入最后一滴KMnO4溶液,恰好变为淡紫色,且半分钟不变色,即可。
③n(MnO4-)=0.1mol·L-1×b×10-3L,n(NO2-)= n(MnO4-)×5/2×250/25=2.5×10-3bmol,NaNO2的质量分数= n(NO2-)×M(NaNO2)/a=172.5×10-3b/a。


科目:高中化学 来源: 题型:
【题目】在溶液中有浓度均为0.01mol·L-1的Fe3+、Cr3+、Zn2+、Mf2+等离子,已知:
Ksp[Fe(OH)3]=2.6×10-39;Ksp[Cr(OH)3]=7.0×10-31
Ksp[Zn(OH)2]=1.0×10-17;Ksp[Mg(OH)2]=1.8×10-11
当氢氧化物开始沉淀时,下列哪一种离子所需溶液的pH最小
A. Fe3+ B. Cr3+ C. Zn2+ D. Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用15.8g高锰酸钾氧化密度为1.19g/cm3、质量分数为36.5%的盐酸以制取氯气。反应如下:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O
求:(1)生成Cl2在标况下的体积?____
(2)求盐酸的浓度?____
(3)如果恰好完全反应,求所需盐酸的体积?____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】轮烷的某种合成原料由C、H、O三种元亲组成,其球棍模型如图所示。

下列说法正确的是
A. 该化合物的名称为乙酸乙酯
B. 该化合物与Br2的四氯化碳溶液不反应
C. 该化合物能发生水解反应,不能发生加聚反应
D. 该化合物的链状同分异构体中,能与 NaHCO3反应放出CO2的只有3种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D分别是盐酸、碳酸钠、氯化钙、硝酸银四种溶液中的一种。将它们两两混合后,观察到的现象如表所示(“↓”表示生成沉淀,“↑”表示生成气体,“——”表示不反应)。请据此回答:

(1)写出A、B、C溶液中溶质的名称或化学式:
A__ B___ C____
(2)C和D反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲是利用一种微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成环境友好物质的装置,同时利用此装置的电能在铁上镀铜。下列说法中正确的是
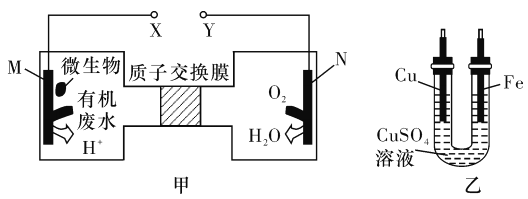
A. 铜电极应与X相连接
B. H+经过质子交换膜由右向左移动
C. 当N电极消耗0. 25 mol气体时,则铁电极增重16 g
D. M电极反应式:CO(NH2)2+H2O-6e- =CO2↑+N2↑+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 在常温、常压下,11.2 L N2含有的分子数为0.5NA
B. 标准状况下,22.4 L H2和O2的混合气体所含分子数为NA
C. 18 g H2O的物质的量是1mol
D. 标况下,1 mol SO2的体积是22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.“抗坏血酸”维生素C具有还原性
B.杨万里《戏笔》中写道“野菊荒苔各铸钱,金黄铜绿两争妍”,铜绿的主要成分为碱式碳酸铜, Cu2(OH)2CO3属于碱式盐
C.向碳酸钠溶液中滴加稀盐酸,先不冒气泡,后冒气泡
D.食物腐败、钟乳石的形成、植物光合作用都与氧化还原反应有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗心律失常药物心律平的合成路线如下:

已知:① R-OH + Cl-R![]() R-O-R + HCl
R-O-R + HCl
②R-CHO+![]()
![]()
![]() + H2O
+ H2O
请回答:
(1)A属于链烃,则A中所含的官能团是______。
(2)B中无甲基,A→B的反应类型是______反应。
(3)C的结构简式是______。
(4)E中含有三元环,且无羟基,则D→E的化学方程式是______。
(5)结合官能团的性质,解释F→G的转化中需酸化的原因:______。
(6)H的结构简式是______。
(7)I→J的化学方程式是______。
(8)在I→J的反应中,生成J的同时会有副产物K,K与J互为同分异构体,则K的结构简式是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com