
【题目】下列反应中,不能产生黑色固体的是( )
A. 铜在硫蒸气中燃烧 B. 铁粉和硫粉混合后点燃
C. H2S通入硫酸亚铁溶液中 D. H2S通入硫酸铜溶液
科目:高中化学 来源: 题型:
【题目】下列条件下,两瓶气体所含原子数一定相等的是
A. 同质量、不同密度的N2和CO B. 同温度、同体积的H2和N2
C. 同体积、同密度的CH4和NH3 D. 同压强、同体积的O2和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25 ℃时, Kb(NH3·H2O)=1.8×10-5。 该温度下,用 0.100mol·L-1 的氨水滴定 10.00 mL 0.100mol·L-1 的一元酸 HA 的溶液, 滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法不正确的是

A. HA 为强酸
B. a=10
C. 25 ℃时,NH4+的水解平衡常数为![]()
D. 当滴入 20 mL 氨水时,溶液中存在 c(NH4+)>c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据实验要求完成下列问题。
Ⅰ、实验室需要配制480mL0.1mol/L的稀硫酸。
(1)若用密度为1.84g/mL,质量分数为98%的浓硫酸来配制,需要用量筒量取浓硫酸_______mL。
(2)该实验除了需要用到量筒、烧杯和玻璃棒之外,还需要用到的玻璃仪器是_____________。
(3)配制溶液时,下列操作会导致所配溶液浓度偏高的操作是__________。
A.用蒸馏水洗涤烧杯,洗涤液没有全部注入容量瓶中
B.定容摇匀后,发现液面低于刻度线,又加水到刻度线位置
C.定容时仰视刻度线
D.容量瓶用蒸馏水洗涤后未进行干燥处理,底部有少量水残留
E.用量筒量取浓硫酸时,仰视刻度线
Ⅱ、Fe(OH)3胶体可使水中悬浮物凝聚沉淀,是城市饮用水处理新技术。
(1)实验室制取Fe(OH)3胶体的操作是往_______(填序号)中逐滴加入________(填序号),继续煮沸至出现红褐色即停止加热。
①沸水 ②NaOH溶液 ③饱和FeCl3溶液
(2)相应的化学方程式是______________________________________________。
(3)向Fe(OH)3胶体中逐滴加入硅酸胶体,逐渐出现红褐色沉淀,出现该现象的原因是_____。
(4)除去胶体中混有的FeCl3和HCl的方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向25 mL 0.1 mol.L-1NaOH溶液中逐滴滴加0.2 mol.L-1的HN3(叠氮酸)溶液,pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7)。下列说法正确的是
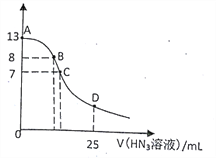
A. 水电离出的c(H+):A点小于B点
B. 在B点,离子浓度大小为c(OH-)>c(H+)>c (Na+)>c(N3-)
C. 在C点,滴加的V(HN3)=12.5 mL
D. 在D点,c(Na+)=2c(HN3)+2 c(N3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧(O3)在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t如下表所示。己知:O3的起始浓度为0.0216 mol·L-1。
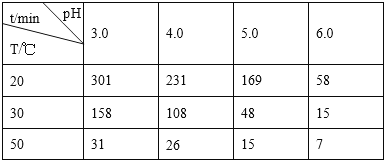
则下列说法不正确的是
A. 30℃、pH=4.0 条件下,O3 的分解速率为 1.00×l0-4mol·L-1·min-1
B. pH增大能加速O3分解
C. 30℃、pH=7.0条件下分解速率小于40℃、pH=3.0
D. 10℃、pH=4.0条件下O3的浓度减少一半所需的时间(t)大于231min
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2和Br2蒸汽都是红棕色、有刺激性气味的气体。下列不能用来区别这两种气体的试剂是( )
A. CCl4 B. 蒸馏水 C. 浓硫酸 D. AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cl-、Br-、Fe2+、I-的还原性依次增强。现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示,请回答:
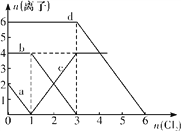
(1)c线分别代表溶液中____________的变化情况;
(2)原溶液中Fe2+与Br-的物质的量之比为____________;
(3)当通入2mol Cl2时,溶液中离子反应为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五氧化二钒(V2O5)是重要的催化剂,可用某钒矿石(含有 V2O3、Fe、Al2O3等)来制备,工艺流程如下:
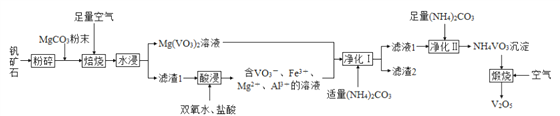
请回答下列问题:
(1) 钒矿石“粉碎”的目的为__________。
(2)“滤渣1” 中除 Al2O3、 Fe(VO3)2、 Fe(VO3)3外,还含有__________(填化学式)。
(3)“酸浸”时,若用硝酸代替双氧水和盐酸,弊端为__________。
(4)“滤渣 2” 的主要成分为 MgCO3、Fe(OH)3和 Al(OH)3,其中生成 Al(OH)3的离子方程式为__________。
(5) 若“净化Ⅰ” 时直接加入足量的(NH4)2CO3,可能导致的后果为__________。
(6)“煅烧”时,还生成参与大气循环的气体,该反应的化学方程式为__________。
(7)产品中 V2O5纯度的测定: 称取产品 a g, 先用硫酸溶解,得到(VO2)2SO4溶液;再加入 V1 mL c1 mol·L-1 (NH4)2Fe(SO4)2溶液(VO2++2H++Fe2+=VO2++Fe3++H2O); 最后用 c2 mol·L-1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗 KMnO4标准溶液的平均体积为 V2 mL。假设杂质不参与反应,则产品中 V2O5的质量分数为__________%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com