
下列有关离子晶体的数据大小比较不正确的是( )。
A.熔点:NaF>MgF2>AlF3
B.晶格能:NaF>NaCl>NaBr
C.阴离子的配位数:CsCl>NaCl>CaF2
D.硬度:MgO>CaO>BaO
 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
下列各组离子能在指定溶液中共存的是 ( )
①无色溶液中: 、
、 、
、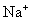 、
、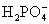 、
、 、
、
②使pH试纸变深蓝的溶液中: 、
、 、
、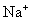 、
、 、
、 、
、
③水电离的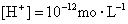 的溶液中:
的溶液中: 、
、 、
、 、
、 、
、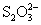
④加入Mg能放出 的溶液中:
的溶液中: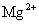 、
、 、
、 、
、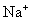 、
、
⑤使甲基橙变红的溶液中: 、
、 、
、 、
、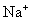 、
、
⑥pH=0的溶液中: 、
、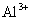 、
、 、
、 、
、 、
、
A.①③ B.②④⑤ C.①②⑤ D.③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32―、SO32―、SO42―、C1―中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
下列说法正确的是( )
A.X中肯定存在Fe2+、NH4+、SO42― B.溶液E和气体F不能发生化学反应
C.X中肯定不存在CO32―、SO32―、C1― D.沉淀I是A1(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
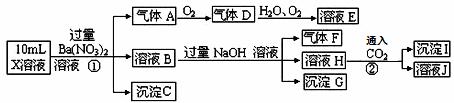
A、B、C、D是中学常见的混合物分离或提纯的基本装置。
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将A、B、C、D填入适当的空格中。
(1)除去Ca(OH)2溶液中悬浮的CaCO3__________________________________________;
(2)从碘水中提取碘__________________________________________;
(3)用自来水制取蒸馏水___________________________________;
(4)分离植物油和水_______________________________________;
(5)除去粗盐中的泥沙__________________________________________;
(6)与海水晒盐原理相符的是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列性质适合于某种原子晶体的是 ( )。
A.熔点1 070 ℃,易溶于水,水溶液导电
B.熔点10.32 ℃,液态不导电,水溶液导电
C.能溶于CS2,熔点112 ℃,沸点444.6 ℃
D.熔点3 550 ℃,很硬,不溶于水,不导电
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的一种1:2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有________种不同运动状态的电子,T原子有________种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为________(用元素符号表示)。
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为________。
(4)Z与R能形成化合物甲,1 mol甲中含________ mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为________。
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为_________________
________________________________________________________。
| 氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
| 熔点/K | 993 | 1 539 | 183 |
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为__________________________。
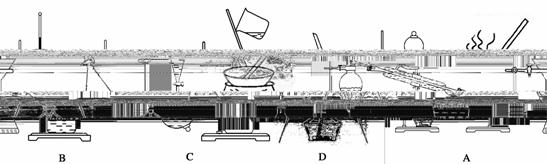
(7)X单质的晶胞如图所示,一个X晶胞中有________个X原子;若X晶体的密度为ρ g·cm-3,阿伏加德罗常数的值为NA,则晶体中最近的两个X原子之间的距离为________ cm(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列生活中的化学小实验不合理的是( )
A.用灼烧并闻气味的方法区分化纤织物与纯毛织物
B.用食用醋除去热水瓶中积存的水垢
C.用纯碱溶液洗涤沾有油污的器具
D.用米汤检验加碘盐中的碘酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
已知MgO、MgCl2的熔点分别为2800℃、604℃,将MgO、MgCl2加热熔融后通电电解,都可得到金属镁。海水中含有MgCl2,工业上从海水中提取镁,正确的方法是( )
A. 海水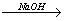 Mg(OH)2
Mg(OH)2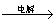 Mg
Mg
B. 海水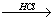 MgCl2溶液
MgCl2溶液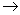 MgCl2熔融
MgCl2熔融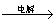 Mg
Mg
C. 海水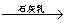 Mg(OH)2
Mg(OH)2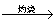 MgO
MgO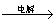 Mg
Mg
D.海水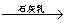 Mg(OH)2
Mg(OH)2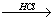 MgCl2溶液
MgCl2溶液 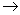 MgCl2熔融
MgCl2熔融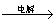 Mg
Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
将NO2装入带活塞的密闭容器中,当反应2NO2(g)N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是 ( )。
A.升高温度,气体颜色加深,则此反应为吸热反应
B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com