
| A、0.1mol?L-1的Na2CO3溶液中,阴离子的总数目大于0.1NA |
| B、常温下,46 g NO2和N2O4混合气体中含有的分子总数为2NA |
| C、标准状况下,22.4L的HF含有NA个分子 |
| D、标准状况下,10g的庚烷分子中含有2.2NA个共价键 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、饱和氯水中 Cl-、NO3-、Na+、SO32- |
| B、加入甲基橙试液呈红色的溶液 NH4+,K+,SO42-,Cl- |
| C、Na2S溶液中 SO42-、K+、Cl-、Cu2+ |
| D、pH=12的溶液中 NO3-、I-、Na+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温同压下甲烷和氧气的密度之比2:1 |
| B、1g甲烷和1g 氧气的原子数之比为5:1 |
| C、等物质的量的甲烷和氧气的质量之比2:1 |
| D、等质量的甲烷和氧气的体积之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
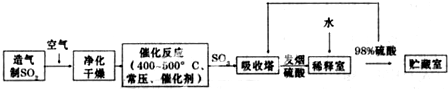
| 氧气 |
| 热空气或 |
| 水蒸气 |
| 碱液 |
| 吸收 |
| 酸化 |
| 蒸馏 |
| 煅烧 |
| 水 |
| 海水 |
| 过滤 |
| 灼烧 |
| 熔化 |
| 电解 |
| 放电 |
| 水 |
| 吸收 |
| 一定条件下 |
| 合成塔 |
| 过量氯气 |
| 水冷 |
| 分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
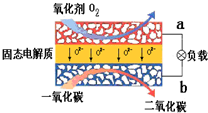 (1)有A、B、C、D四种金属,已知:只有D投入水中可与水剧烈反应;用B和C作电极,稀硫酸作电解质溶液构成原电池时,C为正极;A和C的离子共存于电解液中,以石墨为电极电解时阴极析出A.则这四种金属的活动性由强到弱的顺序是
(1)有A、B、C、D四种金属,已知:只有D投入水中可与水剧烈反应;用B和C作电极,稀硫酸作电解质溶液构成原电池时,C为正极;A和C的离子共存于电解液中,以石墨为电极电解时阴极析出A.则这四种金属的活动性由强到弱的顺序是查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验现象或 预期实验现象 | 现象解释(用 离子方程式表示) | |
| 猜想② | 溶液pH=8 | ||
| 向pH=2的硫酸中 滴加Na2S2O3溶液 | 2S2O32-+2H+══S↓+SO2↑+H2O | ||
| 猜想③ | 向新制氯水中滴加少量Na2S2O3溶液 | 氯水颜色变浅 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com