
| A. | N2(CO):通过灼热的CuO粉末 | B. | Na2SO4溶液(Na2CO3):加盐酸 | ||
| C. | NaCl(NH4Cl):加热 | D. | NO2(NO):通入水中 |
科目:高中化学 来源: 题型:选择题
| A. | 若废水中c(Cl-)<2[c(Fe2+)+c(Cu2+)],则不可能存在Fe3+ | |
| B. | 向废水中加适量盐酸,滴加KSCN溶液,溶液变红,说明废水中含有Fe3+ | |
| C. | 经测定一定量的废水中n(Cu2+)=0.02 mol,n(Fe2+)+n(Fe3+)=0.02 mol,则该一定量的废水中0 mol≤n(Cl-)≤0.1 mol | |
| D. | 取10 mL废水,通入标况下Cl2 22.4 mL恰好完全反应.然后调节pH,使溶液中的铁元素全部转化为Fe(OH)3沉淀,经过滤、洗涤、灼烧,冷却后称重得0.32 g,则废水中c(Fe3+)=0.02 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
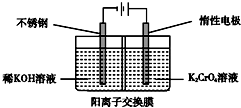
| A. | 在阴极室,发生的电极反应为2H2O+2e-═2OH-+H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程中总反应的化学方程式为4K2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr)为d,则此时铬酸钾的转化率为1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | A | B | C | D |
| 甲中气体 | H2S | H2 | NH3 | NO |
| 乙中气体 | SO2 | Cl2 | HCl | O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它是O3的一种同素异形体 | B. | 它是16O2的同分异构体 | ||
| C. | 18O2与16O2互为同位素 | D. | 1mol18O2分子中含有20mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
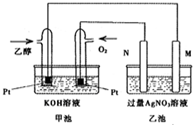 在298K时,1mol C2H5OH在氧气中完全燃烧生成二氧化碳和液态水放出热量1366.8kJ.
在298K时,1mol C2H5OH在氧气中完全燃烧生成二氧化碳和液态水放出热量1366.8kJ.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com