
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算氯气的物质的量,发生反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+H2O,根据方程式计算二氧化锰的物质的量,再根据m=nM计算其质量;
(2)被氧化的HCl生成氯气,根据氯气的物质的量利用氯原子守恒计算被氧化HCl的物质的量;
(3)根据Cl元素守恒计算生成AgCl的质量.
解答 解:(1)n(Cl2)=$\frac{19.04L}{22.4L/mol}$=0.85mol,
MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+H2O
1 1
n(MnO2) 0.85mol
所以n(MnO2)=0.85mol
m(MnO2)=0.85mol×87g/mol=73.95g,所以软锰矿的质量分数为:$\frac{73.95g}{120g}×100%$=61.6%,
答:软锰矿的质量分数为61.6%;
(2)n(Cl2)=0.85mol,被氧化的HCl生成氯气,由氯元素守恒可知,被氧化的n(HCl)=2n(Cl2)=0.85mol×2=1.7mol,
答:被氧化的HCl的物质的量为1.7mol;
(3)原溶液中含有n(Cl-)=$\frac{36.5%×400g}{36.5}$=4mol,
被氧化的n(Cl-)=1.7mol,
则反应后溶液中剩余n(Cl-)=4mol-1.7mol=2.3mol,
所以能生成AgCl的物质的量为2.3mol,质量为2.3mol×143.5g/mol=330.05g,
答:理论上可得330.05gAgCl沉淀.
点评 本题考查物质的量浓度、化学反应的相关计算,题目难度不大,注意掌握物质的量浓度与质量分数的关系.


科目:高中化学 来源: 题型:选择题
| A. | 铝常温下不与氧气反应 | |
| B. | 铝常温下不与浓硫酸反应产生气体,是因为发生钝化 | |
| C. | 向氯化铝溶液中逐滴加入氨水的现象是先产生白色沉淀,后白色沉淀又溶解 | |
| D. | 氧化铝只能与酸反应,不能与碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
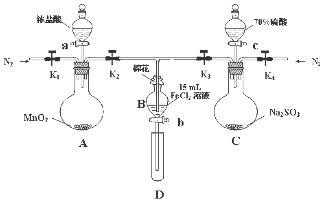 为了验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
为了验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
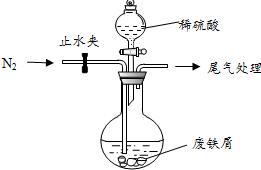 绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:
绿矾(FeSO4•7H2O)是治疗缺铁性贫血的特效药.某化学兴趣小组对绿矾进行了如下的探究:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 68.76 kJ | B. | 57.3 kJ | C. | 34.38 kJ | D. | 17.19 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
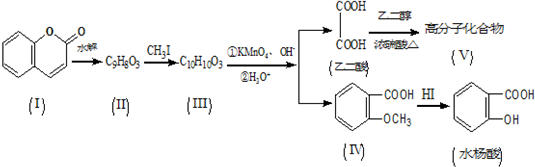
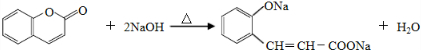 .
.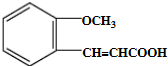 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com