
| A.16O2与18O3互为同位素 |
| B.氧元素与其他短周期非金属元素均能形成酸性氧化物 |
| C.氧与钠形成的稳定化合物中,阴、阳离子个数比均为1:2 |
| D.O2变成O3以及16O变成18O的变化均属于化学变化 |
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案科目:高中化学 来源:不详 题型:单选题
| A.若它能形成①时,则不可能形成②,③ |
| B.若它能形成②时,则还可以形成③,④ |
| C.若它能形成①时,则不可能形成④ |
| D.若它能形成②时,则可以形成① |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
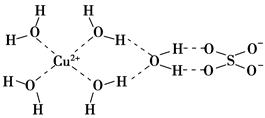
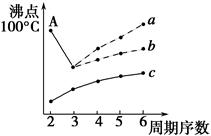
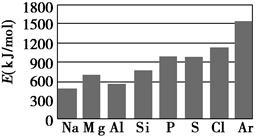
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.与H2化合时X单质比Y单质容易 |
| B.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 |
| C.X原子的最外层电子数比Y原子的最外层电子数多 |
| D.X单质可以把Y从其氢化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
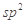 杂化
杂化 键和1个大
键和1个大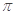 键,C2H2是非极性分子
键,C2H2是非极性分子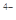 中不存在______________________________________。
中不存在______________________________________。 键 E.
键 E.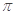 键
键查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1s22s22p63s23p2→1s22s22p63s23p1 |
| B.1s22s22p63s23p3→1s22s22p63s23p2 |
| C.1s22s22p63s23p4→1s22s22p63s23p3 |
| D.1s22s22p63s23p63d104s24p2→1s22s22p63s23p63d104s24p1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com