
| A、25℃时,pH=7的NH4Cl与NH3?H2O混合溶液:c(H+)=c(OH-)=c(NH4+)=c(Cl-) |
| B、0.1mol/L Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S) |
| C、25℃时,pH=2的HCOOH与pH=12的NaOH等体积混合:c(HCOO-)+c(H+)>c(Na+)+c(OH-) |
| D、0.1mol/L Na2CO3溶液与0.1mol/L NaHCO3溶液等体积混合:2c(CO32-)+2c(HCO3-)+2c(H2CO3)=3c(Na+) |


 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁和稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、钠和水反应:Na+2H2O=Na++2OH-+H2↑ |
| C、铁与FeCl3溶液反应:Fe+Fe3+═2Fe2+ |
| D、硫酸铝溶液与氨水反应:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
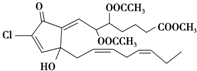 从一种珊瑚中分离出的活性含氯化合物punaglandin具有很强的抗癌活性,它的结构简式如图,有关该化合物的说法正确的是( )
从一种珊瑚中分离出的活性含氯化合物punaglandin具有很强的抗癌活性,它的结构简式如图,有关该化合物的说法正确的是( )| A、分子有3种含氧官能团 |
| B、分子中所有碳原子可以处于同一平面 |
| C、1mol该物质最多消耗4mol NaOH或3mol Br2 |
| D、该物质中只有一种官能团能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将CO2慢慢通入一定体积的NaOH溶液中,溶液的pH随CO2体积(标准状况下)的变化曲线如图所示,则下列说法中正确的是( )
将CO2慢慢通入一定体积的NaOH溶液中,溶液的pH随CO2体积(标准状况下)的变化曲线如图所示,则下列说法中正确的是( )| A、NaOH溶液的物质的量浓度为0.1mol/L,体积为1L |
| B、M、N点离子浓度的都是c(HCO3-)>c(CO32-) |
| C、V=3.36L时,溶液中的离子浓度关系是:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
| D、曲线上任意点都符合:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使pH试纸呈红色的溶液中:Fe2+、NO3-、SO42-、Na+ |
| B、由水电离的c(H+)=1×10-14mol?L-1的溶液中:NH4+、K+、Cl-、CO32- |
| C、使酚酞变红的溶液中:Na+、C6H5O-、CH3COO-、CO32- |
| D、能使淀粉碘化钾试纸显蓝色的溶液中:K+、SO42-、I-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯化钠的晶体结构为非等径圆球密堆积 |
| B、晶体尽量采取紧密堆积方式以使其变得比较稳定 |
| C、因为共价键有饱和性和方向性,所以原子晶体不遵循“紧密堆积”原则 |
| D、金属铜和镁均以ABAB方式密堆积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com