
| A、在空气中表面均能生成氧化物 | B、均能与氯气反应,生成物中金属元素化合价数值:Al=Fe>Na | C、均能从溶液中置换出铜 | D、均能与盐酸反应置换出氢气 |


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:阅读理解

 阴极获得钛可能发生的反应或电极反应为:
阴极获得钛可能发生的反应或电极反应为: ,下列说法正确的是
,下列说法正确的是查看答案和解析>>
科目:高中化学 来源:2013届山东省淄博一中高三12月阶段性检测化学试卷(带解析) 题型:单选题
下列有关金属的叙述中,错误的是( )
| A.钠的还原性很强,可以用来冶炼金属钛、锆、铌等 |
| B.纯铁比生铁的耐腐蚀性强 |
| C.铝是比较活泼金属,不能用铝制容器盛放冷的浓硫酸 |
| D.将铜放入稀硫酸中不溶解,再加入一些硝酸钾溶液铜就可溶解 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年山东省高三12月阶段性检测化学试卷(解析版) 题型:选择题
下列有关金属的叙述中,错误的是( )
A.钠的还原性很强,可以用来冶炼金属钛、锆、铌等
B.纯铁比生铁的耐腐蚀性强
C.铝是比较活泼金属,不能用铝制容器盛放冷的浓硫酸
D.将铜放入稀硫酸中不溶解,再加入一些硝酸钾溶液铜就可溶解
查看答案和解析>>
科目:高中化学 来源:山东省模拟题 题型:填空题
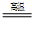 TiCl4+2CO
TiCl4+2CO 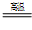 4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因是____________(用化学方程式说明)。
4NaCl+Ti,该反应不能在水溶液中进行,一是因为TiCl4会强烈水解生成TiO2,另一原因是____________(用化学方程式说明)。  。由此看来,高铁酸钠能够杀菌消毒是因为它具有____________性,而能够除去水中悬浮物是因为__________________ 。
。由此看来,高铁酸钠能够杀菌消毒是因为它具有____________性,而能够除去水中悬浮物是因为__________________ 。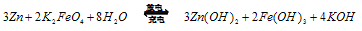 则电池正极材料是_________,充电时电池正极___________(填“得”“失”)电子,放电时电池的负极反应式为 ____________。
则电池正极材料是_________,充电时电池正极___________(填“得”“失”)电子,放电时电池的负极反应式为 ____________。 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com