
| A. | 工业上常用电解法制备元素C、D、E的单质 | |
| B. | 元素A、B组成的化合物常温下一定呈气态 | |
| C. | 化合物AE与CE含有相同类型的化学键 | |
| D. | 元素C、D的最高价氧化物对应的水化物之间肯定不能发生反应 |
分析 A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素B的原子最外层电子数是其电子层数的2倍,结合原子序数可知,B只能有2个电子层,最外层电子数为4,故B为C元素;元素C在同周期的主族元素中原子半径最大,处于IA族,原子序数大于碳元素,则C为Na元素;元素D的合金是日常生活中常用的金属材料,处于第三周期,则D为Al元素;元素A、E的单质在常温下呈气态,A的原子序数小于碳元素,A为H元素,E的原子序数大于铝元素,E为Cl元素,据此解答.
解答 解:A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,元素B的原子最外层电子数是其电子层数的2倍,结合原子序数可知,B只能有2个电子层,最外层电子数为4,故B为C元素;元素C在同周期的主族元素中原子半径最大,处于IA族,原子序数大于碳元素,则C为Na元素;元素D的合金是日常生活中常用的金属材料,处于第三周期,则D为Al元素;元素A、E的单质在常温下呈气态,A的原子序数小于碳元素,A为H元素,E的原子序数大于铝元素,E为Cl元素.
A.工业上电解熔融氯化钠生成金属钠,电解饱和的氯化钠溶液生成氯气等,电解熔融的氧化铝生成铝,故A正确;
B.由C、H元素组成的化合物,可能为气体、液态或固体,比如苯在常温下呈液态,故B错误;
C.化合物AE是HCl,属于共价化合物,含有共价键;化合物CE是NaCl,属于离子化合物,含有离子键,二者含有的化学键类型不同,故C错误;
D.元素C的最高价氧化物对应的水化物是氢氧化钠、D的最高价氧化物对应的水化物是氢氧化铝,氢氧化铝与氢氧化钠反应生成偏铝酸钠,故D错误;
故选A.
点评 本题考查结构性质位置关系应用,难度不大,推断元素是解题的关键,注意对基础知识的理解掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
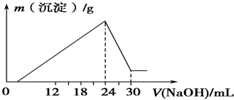
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸不小心沾到皮肤上,立刻用NaOH溶液洗涤 | |
| B. | 实验结束后将所有的废液倒入下水道排出实验室,以免污染实验室 | |
| C. | 实验室制取气体时应先检查装置的气密性 | |
| D. | 做氢气还原氧化铜的实验时先加热再通氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制饭勺、饭盒、高压锅等的不锈钢是合金 | |
| B. | 煎炸食物的花生油和牛油的营养价值一样高 | |
| C. | 做衣服的棉和麻中的纤维素与淀粉互为同分异构体 | |
| D. | 磨豆浆的大豆富含蛋白质,豆浆煮沸后蛋白质变成了氨基酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
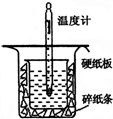 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ICl与水反应可生成 HCl 和 HIO,则1mol ICI 参加反应转移电子为 1mol | |
| B. | 某温度下液态IF5发生电离:2IF5?IF4++IF6-,一定有c (IF4+)×c (IF6-)=c (IF5) | |
| C. | BrCl与Mg反应生成MgCl2和MgBr2 | |
| D. | XYn与卤素单质一样都是非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com