
【题目】A、B、C、D是4种前三周期元素,且原子序数逐渐增大,这四种元素的基态原子的未成对电子数和电子层数相等。请回答下列问题:
(1)D元素的基态原子价电子排布式是:____________________________________;
(2)A、B、C三种元素可以形成化合物A4B2C2,它是厨房调味品之一。1 mol A4B2C2中含有________molσ键,其中B原子采用的杂化方式为:_____________;
(3)元素F的原子序数是介于B和C之间的,元素B、C、F的电负性的大小顺序是: _______________B、C、F的第一电离能的大小顺序是____________(由大到小,用元素符号填空);
(4)随着科学的发展和大型实验装置(如同步辐射和中子源)的建成,高压技术在物质研究中发挥越来越重要的作用。高压不仅会引发物质的相变,也会导致新类型化学键的形成。近年来就有多个关于超高压下新型晶体的形成与结构的研究报道。NaCl 晶体在50~300GPa 的高压下和Na 或Cl2反应,可以形成不同组成、不同结构的晶体。下图给出其中三种晶体的晶胞(大球为氯原子,小球为钠原子)。写出A、B、C 的化学式。A:_______________; B:__________________; C:___________________

(5)磷化硼是一种受到高度关注的耐磨涂料,它可用作金属的表面保护层。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成。合成磷化硼的化学反应方程式:BBr3+PBr3+3H2=BP+6HBr
①分别画出三溴化硼分子和三溴化磷分子的结构。_____________、_________________

磷化硼晶体中磷原子作面心立方最密堆积,硼原子填入部分四面体空隙中。磷化硼的晶胞示意图如下:

②已知磷化硼的晶胞参数a = 478 pm,计算晶体中硼原子和磷原子的核间距(dB-P)(写出计算式,不要求计算结果)____________________________。
【答案】 3s23p3 7 sp2、sp3 O>N>C N>O>C NaCl3 Na3Cl Na2Cl 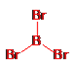 平面三角形
平面三角形  三角锥 dB-P=
三角锥 dB-P=![]() 或(dB-P=
或(dB-P=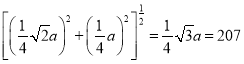 pm)
pm)
【解析】A、B、C、D是4种前三周期元素,且原子序数逐渐增大,这四种元素的基态原子的未成对电子数和电子层数相等。第一周期中,有1个未成对电子的是氢原子,其电子排布式为1s1;第二周期中,未成对电子是2个的有两种分别为:C:1s22s22p2和O:1s22s22p4;第三周期中,未成对电子是3个的是P:1s22s22p63s23p3; A、B、C、D分别为氢元素、碳元素、氧元素和磷元素。(1)D元素的基态原子价电子排布式是:3s23p3;(2)A、B、C三种元素可以形成化合物A4B2C2,它是厨房调味品之一,则为CH3COOH,即醋酸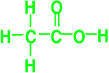 。1 mol CH3COOH中含有7molσ键,其中碳原子采用的杂化方式为:sp2、sp3;
。1 mol CH3COOH中含有7molσ键,其中碳原子采用的杂化方式为:sp2、sp3;
(3)元素F的原子序数是介于碳和氧之间的,故F为氮元素,元素原子的得电子能力越强,则电负性越大,所以O>N>C;同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,C、N、O元素处于同一周期且原子序数逐渐增大,N处于第VA族,所以第一电离能N>O>C;(4)根据晶胞计算A中钠原子数为8×![]() +1=2,氯原子数为12×
+1=2,氯原子数为12×![]() =6,故分子式为NaCl3;B中钠原子数为4×
=6,故分子式为NaCl3;B中钠原子数为4×![]() +2=3,氯原子数为8×
+2=3,氯原子数为8×![]() =1,故分子式为Na3Cl;C中钠原子数为4×
=1,故分子式为Na3Cl;C中钠原子数为4×![]() +2×
+2×![]() +2=4,氯原子数为8×
+2=4,氯原子数为8×![]() =2,故分子式为Na2Cl; (5)①三溴化硼分子中硼原子的价层电子对数为
=2,故分子式为Na2Cl; (5)①三溴化硼分子中硼原子的价层电子对数为![]() =3,B原子按sp2方式杂化,没有孤电子对,所以分子空间构型为平面三角形,结构式为
=3,B原子按sp2方式杂化,没有孤电子对,所以分子空间构型为平面三角形,结构式为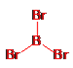 ,三溴化磷分子中磷原子的价层电子对数为
,三溴化磷分子中磷原子的价层电子对数为![]() =4,P原子按sp3方式杂化,有一对孤电子对,所以分子空间构型为三角锥形,结构式为
=4,P原子按sp3方式杂化,有一对孤电子对,所以分子空间构型为三角锥形,结构式为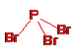 ;②磷化硼晶体中磷原子作立方最密堆积,硼原子填入四面体空隙中,磷原子分布在面心和顶点上,如图所示
;②磷化硼晶体中磷原子作立方最密堆积,硼原子填入四面体空隙中,磷原子分布在面心和顶点上,如图所示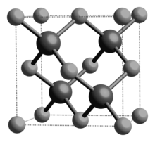 已知磷化硼的晶胞边长a=478pm,则晶胞的体对角线长为
已知磷化硼的晶胞边长a=478pm,则晶胞的体对角线长为![]() a,晶体中硼原子和磷原子的核间距应为体对角线的
a,晶体中硼原子和磷原子的核间距应为体对角线的![]() ,所以dB-P=
,所以dB-P=![]() ×478pm=207pm。
×478pm=207pm。


科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A. 12C、13C、14C是碳的三种同素异形体
B. H2S的电子式可表示为![]()
C. HCl、HBr、HI的稳定性逐渐减弱,而熔沸点逐渐升高
D. NaHSO4在熔融状态下不仅破坏了离子键,还破坏了共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正确表示下列反应的离子方程式的是( )
A. 氢氧化钠溶液与盐酸反应:H++OH-=H2O B. 铁溶于氯化铁溶液:Fe3++Fe=2Fe2+
C. 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O D. 钠与水反应:Na+2H2O=Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法正确的是( )
A. 离子化合物中一定存在离子键,可能存在共价键 B. 非极性键只存在于双原子单质分子中
C. 由金属元素和非金属元素形成的化学键一定是离子键 D. NH4Cl是一种共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的叙述中正确的是( )
A. 所有的金属都是固态的 B. 金属具有导电性、导热性和延展性
C. 所有金属能与酸反应 D. 金属元素在自然界中都是以化合态存在的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】113号元素的元素符号为Nh,中文名称为“弥”,是一种人工合成的放射性化学元素,下列有关该元素的说法中错误的是
A.位于第七周期第ⅢA族
B.化学反应中单质Nh可作氧化剂
C.相同条件下与稀硫酸反应时Nh比A1剧烈
D.最高价氧化物为Nh2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里要配制500mL0.2mol/L的硫酸钠溶液.实验步骤大致有:
(1)请填写下面空白处.
A.在天平上称出 g硫酸钠固体,把它放在烧杯里,用适量的蒸馏水溶解.
B.把得到的溶液小心地沿着玻璃棒注入 mL的容量瓶中.
C.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤液也小心转入容量瓶中.
D.继续向容量瓶中加蒸馏水至液面距刻度1~2cm处,改用 小心滴加蒸馏水至溶液凹液面底部与刻度线水平相切.
E.将瓶塞塞紧,充分摇匀.
F.将配好的溶液倒入试剂瓶中,贴上标签,并洗涤容量瓶.
(2)下列情况会使所配溶液浓度偏高的是 (填序号).
①容量瓶用前内壁沾有水珠 ②没有进行上述的操作步骤C
③未冷却到室温就注入容量瓶定容 ④定容时,水加多了,用滴管吸出
⑤定容时,仰视容量瓶刻度线 ⑥定容时,俯视容量瓶刻度线
(3)如果实验室用98%的浓硫酸(密度为1.8gcm﹣3) 配制 3.6molL﹣1的稀硫酸150mL.计算所需浓硫酸的体积为 mL.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com