
| A. | 9种 | B. | 11种 | C. | 13种 | D. | 15种 |
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 若能与金属钠和碳酸氢钠反应,则其结构中同时含有-OH和-COOH | |
| B. | 若该物质中含有两个-CH3,则它可以是碳酸酯 | |
| C. | 若该物质中结构中不能只含有C-O键和C-H键 | |
| D. | 若1mol C3H6O3与足量钠反应只产生1mol氢气,说明一分子C3H6O3中含有2个-OH和一个-CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸工业生产应考虑综合经济效益问题.
硫酸工业生产应考虑综合经济效益问题.| 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 | |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、K+、SO42- | B. | Ca2+、NO3-、Cl- | C. | Na+、Mg2+、OH- | D. | H+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
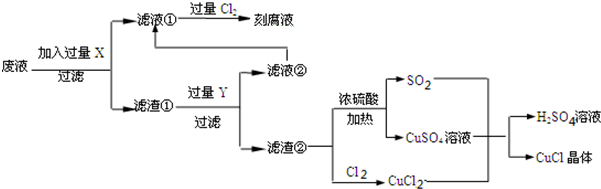
| 1 | 2 | 3 | |
| 空白试验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有乙烯 | B. | 一定有甲烷 | C. | 一定没有甲烷 | D. | 一定没有乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
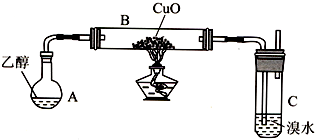
| 试剂、用品 | 预期现象 | |
| 甲 | 酸性高锰酸钾溶液 | 溶液紫红色褪去 |
| 乙 | 溴水 | 溴水褪色 |
| 丙 | 铜丝 酒精灯 | 铜丝由黑色变成光亮的红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com