
下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加几滴浓盐酸后,立即用另一培养皿扣在上面。

对实验现象的“解释或结论”正确的是( )
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性:Fe2+>C1一 |
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
下列反应中,生成的有机物只有一种的是( )
A.异戊二烯(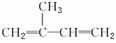 )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B.2?氯丁烷与NaOH乙醇溶液共热发生消去HCl分子的反应
C.新戊烷和氯气发生取代反应生成一氯取代物
D. 甲苯在一定条件下发生硝化反应生成一硝基甲
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镁及其化合物不仅在国防上有重要应用,在化学
研究中也有广泛应用。
(1)某同学研究反应速率时用如下方法:
取一段镁条,用砂纸擦去表面的氧化膜,使足量
镁条与一定量盐酸反应生成H2的量与反应时间
 的关系曲线如图所示。镁与盐酸反应的离子方程
的关系曲线如图所示。镁与盐酸反应的离子方程
式为 ;
在前4min内,镁条与盐酸的反应速率逐渐加快,
在4 min之后,反应速率逐渐减慢,请简述其原因:_____________。
(2)向少量的Mg(OH)2悬浊液中加入适量的饱和氯化铵溶液,固体完全溶解,
写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
(3)Mg Al可形成原电池:
| 编号 | 电极材料 | 电解质溶液 | 电子流动 方向 |
| 1 | Mg Al | 稀盐酸 | Mg流向Al |
| 2 | Mg Al | NaOH溶液 |
根据上表中的实验现象完成下列问题:
①实验1中Mg为 极;
②实验2中电子流动方向 ,Al为 极,为什么? 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在室温下,向一定体积pH=12的Ba(OH)2溶液逐滴加入一定物质的量浓度的NaHSO4溶液。当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A.1∶4 B.1∶1 C.1∶2 D.1∶9
查看答案和解析>>
科目:高中化学 来源: 题型:
安全是顺利进行实验的保障,下列实验处理或方法正确的是( )
A.含氯气的尾气用澄清石灰水吸收较好
B.把氢气和氯气混合光照制氯化氢
C.导管口点燃一氧化碳时也要验纯
D.重金属盐有毒,如果不慎食入氯化钡,喝入硫酸铜溶液即可
查看答案和解析>>
科目:高中化学 来源: 题型:
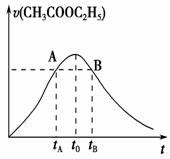
乙酸乙酯能在多种条件下发生水解反应:CH3COOC2H5+H2O CH3COOH+C2H5OH。已知该反应的速率随c(H+)的增大而加快。右图为CH3COOC2H5的水解速率随时间的变化图。下列说法正确的是( )
CH3COOH+C2H5OH。已知该反应的速率随c(H+)的增大而加快。右图为CH3COOC2H5的水解速率随时间的变化图。下列说法正确的是( )
A.反应初期水解速率增大可能是溶液中c(H+)逐渐增大所致
B.A、B两点表示的c(CH3COOC2H5)相等
C.图中to时反应达到平衡状态
D.tB时CH3COOC2H5的转化率低于tA时CH3COOC2H5的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
向一容积不变的密闭容器中充入一定量A和B,发生如下反应:
x A(g)+2B(s)  y C(g);△H <0在一定条件下,容器中 A、C的物质的量浓度 随时间变化的曲线如下图。请回答下列问题:
y C(g);△H <0在一定条件下,容器中 A、C的物质的量浓度 随时间变化的曲线如下图。请回答下列问题:

(1)用A的浓度变化表示该反应0~10min内的平均反应速率v(A)= ;
(2)根据图示可确定x:y= ;
(3)0~l0min容器内压强____ (填 “变大”,“不变”或“变小”)
(4)推测第l0min引起曲线变化的反应条件可能是 (填序号);第16min引起曲线变
化的反应条件可能是____ (填序号);
①减压;②增大A的浓度;③增大C的量;④升温;⑤降温;⑥加催化剂
(5)若平衡I的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1 K2(填“>”“=”或“<”)
查看答案和解析>>
科目:高中化学 来源: 题型:
右图是电解CuCl2溶液的装置,其中c、d为石墨电极。
则下列有关的判断正确的是 ( )
A.a为负极、b为正极
B.a为阳极、b为阴极
C. 电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变

查看答案和解析>>
科目:高中化学 来源: 题型:
在8NH3+3Cl2=N2+6NH4Cl反应中,若有21.3g氯气参加了反应,则被氧化的NH3的物质的量是
A.0.2mol B.163g C.34g D. 3.4g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com