
科目:高中化学 来源: 题型:选择题
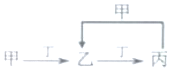 已知甲、乙、丙、丁是由短周期元素W、X、Y、Z组成的化合物,其转化关系如图.已知:X和Z同周期,短周期中X原子半径最大;Y和Z同主族,且Y的质量数等于Z的核电荷数.甲是共价化合物:乙由四种元素组成.下列说法正确的是( )
已知甲、乙、丙、丁是由短周期元素W、X、Y、Z组成的化合物,其转化关系如图.已知:X和Z同周期,短周期中X原子半径最大;Y和Z同主族,且Y的质量数等于Z的核电荷数.甲是共价化合物:乙由四种元素组成.下列说法正确的是( )| A. | 氢化物的稳定性:Z>Y | B. | 离子半径:Z>Y>X | ||
| C. | W可能是金属元素 | D. | W和X均能与Y形成两种离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
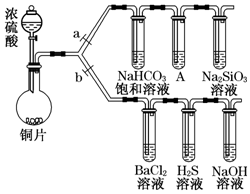 根据要求完成下列实验过程(a、b为弹簧夹,加热及固定装置已略去).
根据要求完成下列实验过程(a、b为弹簧夹,加热及固定装置已略去).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S(s)+O2(g)→SO2(g) Q1 kJ; S(g)+O2(g)→SO2(g) Q2 kJ | |
| B. | 2H2(g)+O2(g)→2H2O(g) Q1kJ; 2H2(g)+O2(g)→2H2O(l) Q2kJ | |
| C. | NaOH(aq)+HCl(aq)→NaCl(aq)+H2O(l) Q1kJ; NaOH(aq)+CH3COOH(aq)→CH3COONa(aq)+H2O(l) Q2 kJ | |
| D. | H2(g)+Cl2(g)→2HCl(g) Q1kJ; H2(g)+F2(g)→2HF(g) Q2kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发时,给蒸发皿内液体加热时,液体不超过容器的$\frac{2}{3}$ | |
| B. | 蒸馏操作时,冷凝管中进冷凝水应是“下进上出” | |
| C. | 盛放NaOH溶液时,使用带橡胶塞的磨口瓶 | |
| D. | 萃取操作时,应选择有机萃取剂,且萃取剂的密度比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| B. | 用FeCl3溶液腐蚀铜板制印刷电路板:2Fe3++Cu═2Fe2++Cu2+ | |
| C. | 向NaAlO2溶液中通入少量CO2制Al(OH)3:AlO2-+CO2+2H2O═HCO3-+Al(OH)3↓ | |
| D. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 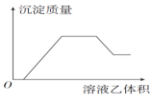 | |
| A | NH4NO3、Al(NO3)3、HCl、Fe(NO3)3 | NaOH | |
| B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 | |
| C | AlCl3、Mg(NO3)2、HNO3 | NaOH | |
| D | NaAlO2、NH3•H2O、NaOH | H2SO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
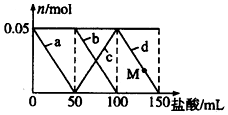 向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )
向含Na2CO3、NaAlO2的混合溶液中逐滴加入150mL 1mol•L-1的HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法正确的是( )| A. | a曲线表示的离子方程式为:AlO2-+H++H2O=Al(OH)3 | |
| B. | b和c曲线表示的离子反应是相同的 | |
| C. | M点时Al(OH)3的质量小于3.9g | |
| D. | 原混合溶液中的CO32-与AlO2-的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④ | B. | ②③④ | C. | ①③⑤ | D. | ①②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com