
现代循环经济要求综合考虑环境污染和经济效益。请填写下列空白:
(1)实验室里,可用于吸收SO2尾气的一种试剂是 。
(2)高纯氧化铁可作现代电子工业材料。以下是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2)为原料制备高纯氧化铁(软磁α-Fe2O3)的生产流程示意图:


①步骤Ⅰ中过滤所得滤渣的主要成分是 。
②步骤Ⅱ 中加入铁粉的目的是 。
中加入铁粉的目的是 。
③步骤Ⅲ中可选用________试剂调节溶液的pH(填标号)。
A.稀硝酸 B.双氧水 C.氨水 D.高锰酸钾溶液
④写出在空气中煅烧FeCO3,制备高纯氧化铁的化学方程式:____________________。
⑤从滤液C中回收的主要物质的一种用途是 。
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
|
| A. | 氯气跟水反应:Cl2+H2O=2H++Cl﹣+ClO﹣ |
|
| B. | 硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO42﹣=BaSO4↓ |
|
| C. | 碳酸钠溶液中加入少量稀盐酸:CO32﹣+H+=HCO3﹣ |
|
| D. | 铜与稀盐酸反应:Cu+2H+=Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的保存方法正确的是 ( )
①少量金属钠保存在酒精中 ②浓硝酸盛放在无色试剂瓶中 ③少量白磷保存在水中 ④氢氟酸保存在带塑料盖的密封玻璃瓶中 ⑤氯水存放在带玻璃塞的无色细口瓶中 ⑥碳酸钠固体保存在带橡皮塞的细口瓶中
A.③ B.③④⑥ C.②③④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列鉴别方法可行的是( )
A.用氨水鉴别Al3+、Mg2+和Ag+
B.用核磁共振氢谱鉴别1-溴丙烷和2-溴丙烷
C.用酸性KMnO4溶液鉴别CH3CH2CH2CH2OH和CH3CH2CH2CHO
D.用Ba(NO3)2溶液鉴别Cl-、SO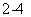 和CO
和CO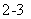
查看答案和解析>>
科目:高中化学 来源: 题型:
某液态卤代烷RX(R是烷基,X是某种卤素原子)的密度是a g·cm-3。该RX可以跟稀碱发生水解反应生成ROH(能跟水互溶)和X-。为了测定RX的分子量,拟定的实验步骤如下:①准确量取该卤代烷b mL,放入锥形瓶中。
②在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热,发生反应。
③反应完成后,冷却溶液,加入稀硝酸酸化,滴入过量的AgNO3溶液,得到白色沉淀
④过滤、洗涤、干燥后称重,得到固体c g。回答问题:
(1)装置中长玻璃管的作用是________________。
(2)步骤④中,洗涤的目的是为了除去沉淀上吸附的________离子。
(3)该卤代烷中所含卤素的名称是____________,判断的依据是_____________。
(4)该卤代烷的分子量是_____________(列出算式)。
(5)如果在步聚③中,加HNO3的量不足,则步骤④中测得的c值将_______。
A.偏大 B.偏小 C.不变 D.大小不定
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列化学方程式:(1)2KI+Cl2=2KCl+I2 (2)2FeCl2+Cl2=2FeCl3
(3)2FeCl3+2HI=2FeCl2+I2+2HCl (4)I2+SO2+2H2O=H2SO4+2HI
判断下列微粒氧化性强弱顺序正确的是
A.Cl2 > Fe3+ > SO2 > I2 B. Cl2 > Fe3+ >I2 >SO2
C. Cl2 > I2 > Fe3+ > SO2 D.Fe3+ > I2 > Cl2 > SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
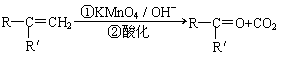 (R、R'可表示烃基或官能团)
(R、R'可表示烃基或官能团)
A可发生如下转化(方框内物质均为有机物,部分无机产物已略去):
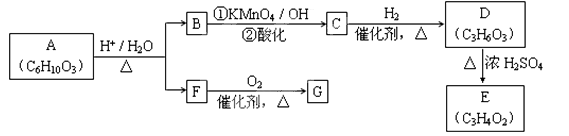
请回答:
(1)F的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基。已知1 mol F与足量金属钠作用产生H2 22.4 L(标准状况),则F的分子式是________,名称是________。
(2)G与F的相对分子质量之差为4,则G具有的性质是________(填字母)。
a.可与银氨溶液反应 b.可与乙酸发生酯化反应
c.可与氢气发生加成反应 d.1 mol G最多可与2 mol新制Cu(OH)2发生反应
(3)D能与NaHCO3溶液发生反应,且两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是________________________,该反应类型是________反应。
(4)H与B互为同分异构体,且所含官能团与B相同,则H的结构简式可能是:
_____________________、____________________。
(5)A转化为B和F的化学方程式是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com