
| A. | 适当加热 | B. | 改用锌粉 | ||
| C. | 加入少量NaCl溶液 | D. | 加入少量1mol•L-1稀硫酸 |
分析 根据影响化学反应速率的因素分析,若增大反应速率,可以升高温度、增大锌的表面积、增大氢离子浓度等,而加入少量氯化钠溶液,导致原溶液中氢离子浓度减小,反应速率减小,据此进行解答.
解答 解:A.适当加热,会加快反应速率,故A不选;
B.锌片改为锌粉,增大了锌的接触面积,可以加快反应速率,故B不选;
C.加入少量氯化钠溶液,钠离子和氯离子不需要锌与氢离子的反应,而原溶液中氢离子浓度减小,导致反应速率减小,故C选;
D.加入1mol/L的稀硫酸,增大了溶液中氢离子浓度,从而加快了反应速率,故D不选;
故选C.
点评 本题考查了化学反应速率及其影响因素,题目难度不大,明确影响化学反应速率的因素为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | Fe的摩尔质量为56g | |
| B. | 常温常压下,71gCl2含有NA个Cl2分子 | |
| C. | 1mol O2在常温下的体积都为22.4L | |
| D. | 将1molNaCl晶体加入到1L水中,得到NaCl溶液的浓度就是1mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内${C_{({H_2})}}={C_{({I_2})}}={C_{(HI)}}$ | B. | 容器内的压强不再变化 | ||
| C. | 断裂1mol H-H的同时生成2mol H-I | D. | 容器内颜色不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
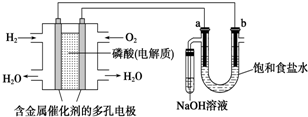
| A. | 电池工作时,正极反应式为:O2+2 H2O+4e-=4OH- | |
| B. | 忽略能量损耗,当电池中消耗0.1g H2时,b极周围会产生1.12L H2 | |
| C. | 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 | |
| D. | 电解时,a 电极周围首先放电的是Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L 苯中含有的苯分子数是NA | |
| B. | 标准状况下,1mol氦气中含有的核外电子数为2NA | |
| C. | 常温常压下,15g乙烷分子数目为 NA | |
| D. | 常温常压下,0.10 mol•L-1CH3COOH溶液中含有的H+数小于0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com