
分析 依据m=nM计算铜的物质的量,依据铜与稀硝酸反应的化学方程式进行计算.
解答 解:19.2g 的Cu的物质的量=$\frac{19.2g}{64g/mol}$═0.3mol,铜与稀硝酸发生反应,方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,依据方程式得:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3 8 3 2
0.3mol 0.8mol 0.3mol 0.2mol
根据方程式计量数关系可知参加反应的硝酸的物质的量是0.8mol;生成硝酸铜的物质的量为0.8mol;生成NO的物质的量为0.2mol;
(1)根据方程式计量数关系可知参加反应的硝酸的物质的量是0.8mol;
答:参加反应的硝酸的物质的量是0.8mol;
(2)生成硝酸铜的物质的量为0.8mol,溶液的体积为500ml,所以硝酸铜的物质的量浓度为:$\frac{0.8mol}{0.5L}$=1.6mol/L;
答:反应结束后溶液加水到500ml,这时硝酸铜的物质的量浓度是1.6mol/L;
点评 本题考查化学方程式的计算,题目难度中等,本题注意根据反应方程式的计算,为解答该题的关键,注意公式的运用.


科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1 NH4NO3溶液中:c(NH4+)>c(NO3-)>c(H+)>c(OH-) | |
| B. | 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 向10 mL 0.2 mol•L-1 NaCl溶液中滴入2 mL 0.1 mol•L-1 AgNO3溶液,溶液中离子浓度大小关系:c(Na+)>c(NO3-)=c(Cl-)>c(Ag+) | |
| D. | 常温下pH=2的醋酸与pH=12的烧碱溶液等体积混合:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
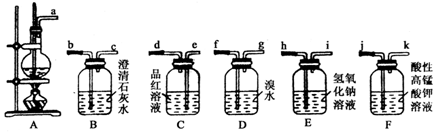
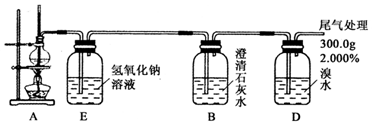
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023个分子的体积约是22.4L | |
| B. | 0.5mol H2的体积为11.2L | |
| C. | 标准状况下,1mol H2O的体积为22.4L | |
| D. | 标准状况下,体积相同的气体所含的分子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
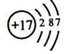 .
.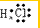 ;由两种元素组成的共价化合物的水溶液呈碱性,这种化合物的结构式为
;由两种元素组成的共价化合物的水溶液呈碱性,这种化合物的结构式为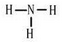 ,四种元素对应的化学性质最稳定的单质的电子式为
,四种元素对应的化学性质最稳定的单质的电子式为 .
.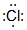 →
→ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (NH4)2SO4溶于水:(NH4)2SO4═2NH4++SO42- | |
| B. | Fe(OH)3溶于水:Fe(OH)3═3OH-+Fe3+ | |
| C. | HF溶于水:HF?H++F- | |
| D. | NaHS溶于水:NaHS=Na++HS-,HS-?H++S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化合物中呈+2价 | B. | 氢氧化物呈两性 | ||
| C. | 单质使水分解,放出氢气 | D. | 碳酸盐难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为K的活泼性强,所以钾应该保存在煤油中 | |
| B. | K在空气中点燃,产物只有K2O | |
| C. | K 与水能够反应,但不如Na与水的反应剧烈,但产物都有氢气 | |
| D. | K可以和CuSO4溶液发生置换反应,置换出Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com