
CO2、NO2、SO2是中学常见的氧化物,下列有关三种氧化物的叙述正确的是( )
| A.它们均可与水反应生成酸,所以都是酸性氧化物 |
| B.它们都是无色、密度比空气大的有毒气体 |
| C.人类活动中过度排放CO2、SO2和NO2,都会引起酸雨 |
| D.它们在反应中都可做氧化剂 |
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:高中化学 来源: 题型:单选题
氯气是一种化学性质很活泼的非金属单质,它具有较强的氧化性,下列叙述中不正确的是( )
| A.红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 |
| B.钠在氯气中燃烧,生成白色的烟 |
| C.氯气能与水反应生成次氯酸和盐酸,久置氯水最终变为稀盐酸 |
| D.在溴化钠和碘化钾的混和溶液中通入过量的氯气,然后将溶液蒸干并灼烧最后留下的物质是氯化钠和溴化钾。 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
科学家发现微量硫化氢可以调节心血管功能。有关硫化氢的叙述正确的是
| A.硫化氢很稳定,受热难分解 |
| B.将硫化氢通入氯水中,氯水褪色并产生浑浊 |
| C.硫化氢在足量氧气中燃烧生成淡黄色固体 |
| D.硫化氢是弱电解质,其电离方程式是H2S ? 2H+ + S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某化学小组用下图所示装置制取氯气,下列说法不正确的是
| A.该装置图中至少存在两处明显错误 |
| B.烧瓶中的MnO2可换成KMnO4 |
| C.在乙后连一盛有饱和食盐水的烧杯可进行尾气处理 |
| D.在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
为验证铜与稀硝酸反应的还原产物是NO而不是NO2,设计了如下图的装置,以下叙述错误的是
| A.应先打开活塞再从右侧加稀硝酸 |
| B.左侧稀硝酸须注满 |
| C.关闭活塞后铜丝会全部溶解 |
| D.反应停止后打开活塞气体变成红棕色 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
叠氮酸钠(NaN3)是无色离子晶体,遇高温或剧烈震动能发生强烈爆炸,快速分解成钠单质和氮气,是汽车安全气囊中的成分之一。下列有关说法正确的是
| A.NaN3中只含有离子键 |
| B.1molNaN3完全分解最多可以产生33.6LN2 |
| C.NaN3快速分解时,NaN3既是氧化剂,又是还原剂 |
| D.常温下,NaN3化学性质稳定,包装盒上无需特别说明注意事项 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关氯气的叙述中不正确的是( )
| A.氯气是一种黄绿色,有刺激性气味的气体 |
| B.氯气,液氯,氯水是同一种物质 |
| C.氯气能溶于水 |
| D.氯气是一种有毒气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)在下图所示的物质转化关系中(部分反应条件及产物省略),化合物A由短周期元素组成,B是常见的无色液体,C是能使湿润的红色石蕊试纸变蓝色的气体,E是淡黄色粉末,D、F、G均为无色气体。
完成下列问题:
(1)写出A的化学式 。
(2)组成F的元素在周期表中位于 周期 族。
(3)B的电子式是 。
(4)反应①的化学方程式: 。
(5)反应②的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图: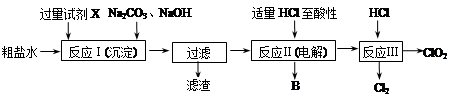
(1)粗食盐水中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是 (填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是 。(已知:Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9)
(2)上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是 ;反应Ⅲ的化学方程式为 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是 。
② 滴定过程中,至少须平行测定两次的原因是 。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为 mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com