
| A. | 生活垃圾焚烧处理后体积一般可减少40%~50% | |
| B. | 生活垃圾焚烧处理后体积一般可减少80%~90% | |
| C. | 因为是封闭式焚烧处理所以没有烟气排放 | |
| D. | 发出的电也有污染,不能用作生活用电 |
科目:高中化学 来源: 题型:解答题
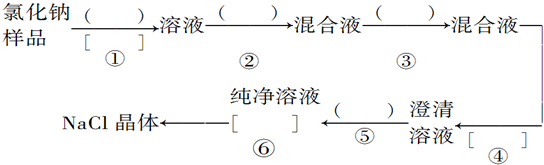
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 2 | E | |||||||
| 3 | A | C | D | G | ||||
| 4 | B | F |
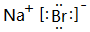 ,高温灼烧该化合物时,火焰呈黄色.
,高温灼烧该化合物时,火焰呈黄色.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
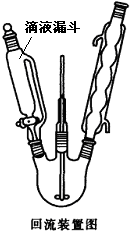 间硝基苯胺(Mr=128)是一种重要的染料中间体.它是一种黄色针状结晶,微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇.间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原(装置如右图所示),其反应式如下:
间硝基苯胺(Mr=128)是一种重要的染料中间体.它是一种黄色针状结晶,微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇.间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原(装置如右图所示),其反应式如下:
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. |  在新型催化剂作用下利用太阳能使水分解的能量变化曲线 | |
| B. |  KNO3溶解度曲线,α点所示溶液为50℃时的不饱和溶液 | |
| C. |  常温下pH=2的HCl溶液加水稀释倍数与pH的变化关系 | |
| D. |  10ml 0.01ml/L KMnO4酸性溶液与过量的0.1mol/L H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.22 mol/L | B. | 0.11 mol/L | C. | 0.022 mol/L | D. | 0.011 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com