

分析 利用锌焙砂(主要成分是ZnO、SiO2,还含有Fe2O3、CuO等)生产碱式碳酸锌的工艺流程:锌焙砂含有少量氧化铜和氧化铁等杂质.加入稀硫酸溶解过滤,ZnO+H2SO4=ZnSO4+H2O,Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、CuO+H2SO4=CuSO4+H2O,滤渣Ⅰ为二氧化硅、不溶性杂质,得到溶液中含有硫酸锌、硫酸铜、硫酸铁,在金属活动顺序表中,锌排在铁、铜的前面,加入过量锌粉锌将三价铁离子还原成亚铁离子,锌置换出铁和铜,滤渣2为Zn、Fe、Cu,过滤得到溶液中加入碳酸钠过滤得到碱式碳酸锌.
(1)二氧化硅不与硫酸反应,氧化锌、氧化铁、氧化铜分别与酸反应生成相应的离子;
(2)二氧化硅和氢氧化钠反应生成硅酸钠和水,通入二氧化碳,二氧化碳和硅酸钠溶液反应生成硅酸沉淀,灼烧分解生成二氧化硅;
(3)在金属活动顺序表中,锌排在铁、铜的前面,加入过量锌粉置换出铁和铜,锌、铁能和硫酸反应,而铜不能,加硫酸从滤渣Ⅱ中获取铜;
(4)碱式碳酸锌分解生成氧化锌,二氧化碳和水,结合元素守恒计算化学式.
解答 解:(1)锌焙砂(主要成分是ZnO、SiO2,还含有Fe2O3、CuO等)加入稀硫酸溶解:ZnO+H2SO4=ZnSO4+H2O,离子反应为:ZnO+2H+=Zn2++H2O,
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,离子反应为:Fe2O3+6H+=2Fe3++3H2O,CuO+H2SO4=CuSO4+H2O,离子反应为:CuO+2H+=Cu2++H2O,二氧化硅不与硫酸反应,
故答案为:ZnO+2H+=Zn2++H2O;Fe2O3+6H+=2Fe3++3H2O(CuO+2H+=Cu2++H2O);
(2)滤渣Ⅰ为二氧化硅、不溶性杂质,二氧化硅与氢氧化钠反应生成可溶性的硅酸钠和水,所以加入氢氧化钠,其反应化学方程式为SiO2+2NaOH═Na2SiO3+H2O,通入二氧化碳,二氧化碳和硅酸钠溶液反应CO2+Na2SiO3+H2O=H2SiO3↓+Na2CO3,生成硅酸沉淀,灼烧分解生成二氧化硅:H2SiO3$\frac{\underline{\;高温\;}}{\;}$SiO2+H2O,
故答案为:①氢氧化钠;②灼烧;
(3)加入过量锌粉锌将三价铁离子还原成亚铁离子3Zn+2Fe3+=3Zn2++2Fe2+,在金属活动顺序表中,锌排在铁、铜的前面,加入过量锌粉置换出铁和铜,锌、铁能和硫酸(或盐酸)反应,而铜不能,加硫酸(或盐酸)从滤渣Ⅱ中获取铜,
故答案为:除去溶液中的Fe2+、Cu2+;向滤渣2中加入过量的稀硫酸(或稀盐酸),充分反应后过滤;
(4)碱式碳酸锌分解生成氧化锌,二氧化碳和水,结合元素守恒计算化学式;加碳酸铵时生成的沉淀是碱式碳酸锌,取该碱式碳酸锌3.41g,在400~500℃下加热至质量不再变化,得到氧化锌2.43g物质的量=$\frac{2.43g}{81g/mol}$=0.03mol,标准状况下的CO2 0.224L,物质的量=$\frac{0.224L}{22.4L/mol}$=0.01mol
水的物质的量=$\frac{3.41g-2.43g-0.01mol×44g/mol}{18g/mol}$=0.03mol
氧元素物质的量=$\frac{3.41g-0.03mol×65g/mol-0.01mol×12g/mol-0.06mol×1g/mol}{16g/mol}$=0.08mol
n(Zn):n(C):n(H):n(O)=0.03:0.01:0.06:0.08=3:1:6:8,碱式盐为Zn3(OH)4CO3•H2O或ZnCO3•2Zn(OH)2•H2O,
故答案为:Zn3(OH)4CO3•H2O或ZnCO3•2Zn(OH)2•H2O.
点评 本题考查了物质分离提纯的实验方法和过程分析判断,为高频考点,侧重于学生的分析能力、实验能力的考查,注意把握题干信息的分析理解,操作步骤的注意问题和基本操作方法,(4)碱式碳酸锌的化学式的计算是解题关键,题目难度中等.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:解答题
| 物质的量 时间 | n(X)/mol | n(Y)/mol | n(M)/mol | n(N)/mol |
| 0 | 2.0 | 1.0 | 1.0 | 1.0 |
| 10min | 1.0 | 2.0 | 3.0 | 4.0 |
| 20min | 0.5 | 2.5 | 4.0 | 5.5 |
| 30min | 0.25 | 2.75 | 4.5 | 6.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol H2SO4的质量就是1个H2SO4分子的质量的98倍 | |
| B. | 水的摩尔质量是18g | |
| C. | 1mol任何物质都含有6.02×1023个原子 | |
| D. | 24g O2分子与24g O3分子所含的氧原子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
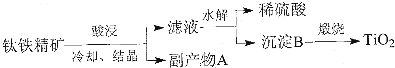
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N P Cl | B. | P O S | C. | N O S | D. | O P Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 任意一种(任写一种).
任意一种(任写一种). .
. 的合成路线流程图.
的合成路线流程图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com