

| A. | 甲电极为阴极 | |
| B. | 为使电解产物全部转化为NH4NO3,需补充的物质为NH3 | |
| C. | 乙电极的电极反应式是:NO-3e-+4OH-=NO3-+2H2O | |
| D. | 该反应中NO既是氧化剂又是还原剂 |
分析 电解NO制备NH4NO3,由图可知乙为阳极反应为NO-3e-+2H2O=NO3-+4H+,甲为阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,据此分析.
解答 解:电解NO制备NH4NO3,由图可知乙为阳极反应为NO-3e-+2H2O=NO3-+4H+,甲为阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3;
A.根据以上分析,甲电极为阴极,故A正确;
B.根据以上分析,则A为NH3,故B正确;
C.乙为阳极反应为NO-3e-+2H2O=NO3-+4H+,故C错误;
D.根据8NO+7H2O$\frac{\underline{\;电解\;}}{\;}$3NH4NO3+2HNO3,则NO既是氧化剂又是还原剂,故D正确;
故选:C.
点评 本题考查了电解原理的应用等,题目涉及的知识点较多,侧重于考查学生的综合运用能力,难度中等,注意基础知识的积累掌握.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
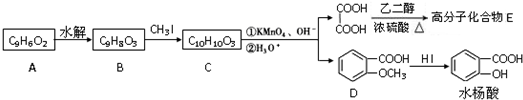
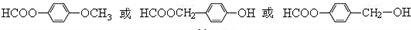 .
.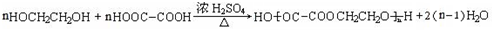 .
.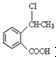 为原料制备
为原料制备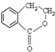 的合成路线流程图(无机试剂任用),并注明反应条件.合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任用),并注明反应条件.合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$H2C=CH2$\stackrel{Br_{2}}{→}$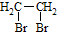 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 限制使用电动车 | |
| B. | 利用太阳能、风能和氢能等能源代替化石燃料 | |
| C. | 鼓励私人购买和使用汽车代替公交车 | |
| D. | 以煤等燃料作为主要生活燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 环保热词“PM2.5”是指大气中直径小于或等于2.5 微米(1微米=1×10-6米)的颗粒,“PM2.5”与空气形成的分散系属于胶体 | |
| B. | 食盐中加入少量碘化钾,食用后可补充人体内碘元素的不足 | |
| C. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量,石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 | |
| D. | 晶体硅是通信工程中制作光导纤维的主要原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | Ⅰ | Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | SiO2有导电性 | SiO2可用于制备光导纤维 |
| C | Fe3+有氧化性 | 利用30%的FeCl3溶液腐蚀铜箔制造印刷线路板 |
| D | C12有剧毒 | 大量氯气泄漏时,用烧碱溶液浸湿软布蒙面,并迅速离开现场 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录.
下表是某学生为探究AgCl沉淀转化为Ag2S沉淀的反应所做实验的记录.| 步 骤 | 现 象 |
| Ⅰ.取5mL 0.1mol/L AgNO3与一定体积0.1mol/L NaCl溶液,混合,振荡. | 立即产生白色沉淀 |
| Ⅱ.向所得悬浊液中加入2.5mL 0.1mol/L Na2S溶液. | 沉淀迅速变为黑色 |
| Ⅲ.将上述黑色浊液,放置在空气中,不断搅拌. | 较长时间后,沉淀变为乳白色 |
| Ⅳ.滤出Ⅲ中的乳白色沉淀,加入足量HNO3溶液. | 产生红棕色气体,沉淀部分溶解 |
| Ⅴ.过滤得到滤液X和白色沉淀Y;向X中滴加Ba(NO3)2溶液. | 产生白色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com