
| 酸 | HClO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 1.6×10-9 | 4.2×10-10 |
分析 (1)已知:①3N2H4(l)?4NH3(g)+N2(g)△H=-336.6kJ•mol-1
②N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
则①×$\frac{1}{3}$-②×$\frac{2}{3}$得到N2H4(g)?N2(g)+2H2(g),据盖斯定律来计算;平衡常数K=$\frac{各生成物平衡浓度系数次幂之积}{各反应物平衡浓度系数次幂之积}$;
(2)电解池可以实现分自发的氧化还原反应的发生,根据自发进行的判据△H-T△S<0来判断;在电解池的阴极上发生得电子的还原反应,据此回答;
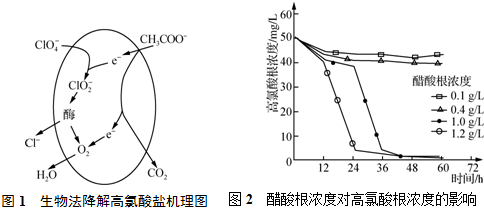
(3)Ⅰ、①微生物的催化下,ClO4-可被CH3COO-还原,得到二氧化碳和氯离子,据此书写离子方程式;
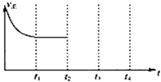
②根据CH3COO-的浓度对ClO4-降解程度的影响图可以看出:CH3COO-浓度过低,不能促进微生物生长;
Ⅱ、电离平衡常数越大,酸的电离程度越大,酸性越强;在冰醋酸中,盐酸不能完全电离,据此回答.
解答 解:(1)已知:①3N2H4(l)?4NH3(g)+N2(g)△H=-336.6kJ•mol-1
②N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
据盖斯定律,则①×$\frac{1}{3}$-②×$\frac{2}{3}$得到N2H4(g)?N2(g)+2H2(g),所以
△H=(-336.6kJ•mol-1)×$\frac{1}{3}$-(-92.4kJ•mol-1)×$\frac{2}{3}$=-50.6kJ•mol-1,平衡常数K=$\frac{各生成物平衡浓度系数次幂之积}{各反应物平衡浓度系数次幂之积}$=$\frac{[{N}_{2}][{H}_{2}]^{2}}{[{N}_{2}{H}_{4}]}$,
故答案为:-50.6;K=$\frac{[{N}_{2}][{H}_{2}]^{2}}{[{N}_{2}{H}_{4}]}$;
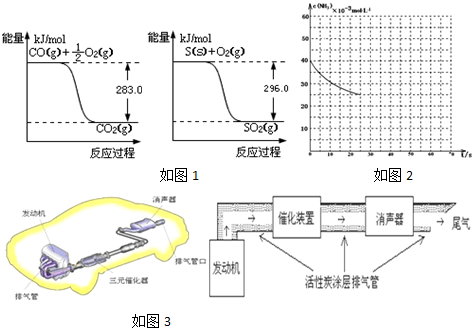
(2)转化2CO2$\frac{\underline{\;通电\;}}{\;}$2CO+O2是一个熵增加的反应,有利于自发进行;在电解池的阴极上发生得电子的还原反应,阴极的反应式为:2CO2+4e-+2H2O=2CO+4OH-,
故答案为:△S>0;2CO2+4e-+2H2O=2CO+4OH-;
(3)Ⅰ、①微生物的催化下,ClO4-可被CH3COO-还原,得到二氧化碳和氯离子,离子方程式为:ClO4-+CH3COO-+H+=2CO2+2H2O+Cl-,故答案为:ClO4-+CH3COO-+H+=2CO2+2H2O+Cl-;
②根据CH3COO-的浓度对ClO4-降解程度的影响图可以看出:CH3COO-浓度过低,不能促进微生物生长CH3COO-浓度小于0.4g/L的条件下,ClO4-的降解几乎停滞,故答案为:CH3COO-浓度过低,不能促进微生物生长,失去催化作用,反应速率显著降低;
Ⅱ、电离平衡常数越大,酸的电离程度越大,酸性越强,所以这三种酸酸性最强的是HClO4;在冰醋酸中,盐酸不能完全电离,电离方程式为:HCl?H++Cl-.
故答案为:HClO4;HCl?H++Cl-.
点评 本题综合考查学生盖斯定律的应用、电解池的工作原理以及弱电解质的电离等方面的知识,属于综合知识的考查,注意知识的迁移应用是关键,难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3:1:4 | B. | 2:1:1 | C. | 1:1:1 | D. | 1:2:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨、烧碱在工农业生产和工业废水处理中具有广泛用途.回答下列问题:
氨、烧碱在工农业生产和工业废水处理中具有广泛用途.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.
2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需的时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com