
��8�֣���Cu2+��Һ����������Fe3+ʱ�����õ���pH�ķ�����ʹFe3+������ȫ����Ϊ��Fe3+������ȫʱCu2+��û�п�ʼ��������ͬѧΪ̽����Mg2+��Һ����������Fe3+ʱ���Ƿ�Ҳ���������������г��ӣ��ز����й��������£�����ʱ��Ksp[Mg(OH)2]��4��10��12��Ksp[Fe(OH)3]��8.0��10-38��ͨ����Ϊij���Ӳ�������Һ�е�Ũ��С��1��10-5 mol?L-1ʱ����Ϊ�������Ѿ�������ȫ��
�ٶ�ԭ��Һ��c(Mg2+)=1mol?L��1��c(Fe3+)=0.01mol?L��1��
��1��ʹFe3+��ʼ����ʱ��Һ��pHԼΪ ��
��2����Fe3+������ȫʱ��Һ��c(OH��)ԼΪ mol/l����ʱ��Mg2+ ����д��ţ�A����δ��ʼ������B���Ѿ���ʼ������C���Ѿ�������ȫ����
��3�����ۣ�����������Fe3+��Mg2+��Һ�У� �����ţ�A�����ԣ�B�������ԣ��õ���pH�ķ��������ӡ�

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
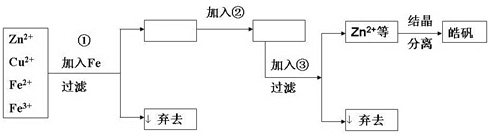
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
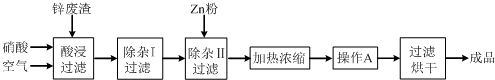
| �������� | Al��OH��3 | Fe��OH��3 | Fe��OH��2 | Cu��OH��2 | Zn��OH��2 |
| ��ʼ������pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| ������ȫ��pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���㽭ģ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2009���㽭ʡ�߿���ѧģ���Ծ����¿α꣩�������棩 ���ͣ������
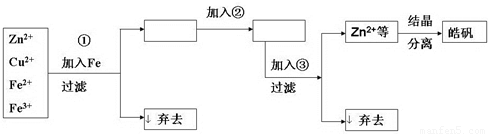
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com