
| A. | 3.36L | B. | 1.12L | C. | 2.24L | D. | 4.48L |
分析 n(HCl)=1.5mol/L×0.2L=0.30mol,如果n(Na2CO3):n(HCl)=1:1,则碳酸钠和稀盐酸反应方程式为Na2CO3+HCl=NaHCO3+NaCl,如果n(Na2CO3):n(HCl)=1:2,碳酸钠和稀盐酸反应方程式为Na2CO3+2HCl=2NaCl+CO2↑+H2O,实际上n(Na2CO3):n(HCl)=0.20mol:0.30mol=2:3,则发生的反应为Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+CO2↑+H2O,
Na2CO3+HCl=NaHCO3+NaCl、
1mol 1mol 1mol
0.2mol 0.2mol0.2mol
则剩余n(HCl)=(0.3-0.2)mol=0.1mol,
NaHCO3+HCl=NaCl+CO2↑+H2O,
1mol 1mol 1mol
0.1mol 0.1mol 0.1mol
根据方程式知,有0.1mol二氧化碳生成,根据V=nVm计算二氧化碳体积.
解答 解:n(HCl)=1.5mol/L×0.2L=0.30mol,如果n(Na2CO3):n(HCl)=1:1,则碳酸钠和稀盐酸反应方程式为Na2CO3+HCl=NaHCO3+NaCl,如果n(Na2CO3):n(HCl)=1:2,碳酸钠和稀盐酸反应方程式为Na2CO3+2HCl=2NaCl+CO2↑+H2O,实际上n(Na2CO3):n(HCl)=0.20mol:0.30mol=2:3,则发生的反应为Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+CO2↑+H2O,
Na2CO3+HCl=NaHCO3+NaCl、
1mol 1mol 1mol
0.2mol 0.2mol0.2mol
则剩余n(HCl)=(0.3-0.2)mol=0.1mol,
NaHCO3+HCl=NaCl+CO2↑+H2O,
1mol 1mol 1mol
0.1mol 0.1mol 0.1mol
根据方程式知,有0.1mol二氧化碳生成,V(CO2)=nVm=0.1mol×22.4L/mol=2.24L,
故选C.
点评 本题考查化学方程式有关计算,为高频考点,侧重考查学生分析计算能力,明确发生的反应是解本题关键,注意要进行过量计算判断,注意碳酸钠和稀盐酸反应先后顺序,为易错题.


科目:高中化学 来源: 题型:选择题
| A. | 每消耗1molCH4可以向外电路提供4mole- | |
| B. | 电池放电后,溶液PH不断升高 | |
| C. | 负极上O2得到电子,电极反应式为:O2+2H2O+4e-═4OH- | |
| D. | 负极上CH4失去电子,电极反应式:CH4+10OH--8e-═CO32-+7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| B. | 将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O | |
| C. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O | |
| D. | 将铁粉加入稀硫酸中:2Fe+6H+=2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
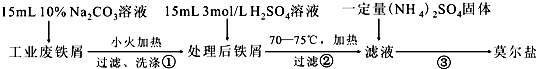
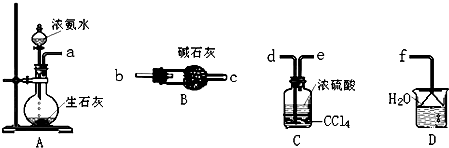

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
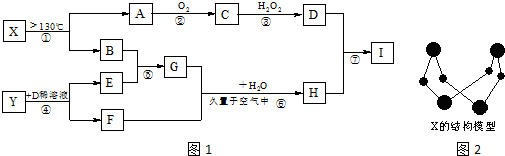
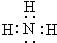 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com