
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。

(1)下图所示:1mol CH4完全燃烧生成气态水的能量变化和1mol S(g)燃烧的能量变化。在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式________________________________________________________。
(2)焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g)![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率与S2(g)的生成速率随温度变化的关系如图所示:
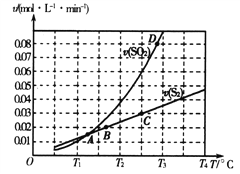
①A、B、C、D四点对应的状态中,达到平衡状态的有_____________(填字母)。
②该反应的△H_____0(填“>”“<”或“=”)。
③下列措施能够增大SO2平衡转化率的是______________。
A.降低温度 B.增加C的量 C.减小容器体积 D.添加高效催化剂
(3)用氨水吸收SO2。25℃时2.0mol·L-1的氨水中,NH3·H2O的电离度α=______(![]() ×100%)。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的
×100%)。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的![]() =_______。(已知25℃,Kb(NH3·H2O)=1.8×10-5;Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8)
=_______。(已知25℃,Kb(NH3·H2O)=1.8×10-5;Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8)
(4)当吸收液失去吸收能力后通入O2可得到NH4HSO4溶液,用如图所示装置电解所得NH4HSO4溶液可制得强氧化剂(NH4)2S2O8

①写出电解NH4HSO4溶液的化学方程式____________。
②若用9.65A的恒定电流电解饱和NH4HSO4溶液1小时,理论上生成的(NH4)2S2O8的物质的量为________。(F=96500C·mol-1)
【答案】 CH4(g)+2SO2(g)=2S(g)+CO2(g)+2H2O(g), H=352 KJ/mol; C < A 0.3% 0.62 2NH4HSO4==(NH4)2S2O8+H2↑ 0.18mol
【解析】(1)根据图像可知:①CH4(g)+2O2(g)===CO2(g)+2H2O(g)△H=Ea1-Ea2=126-928=-802J/mol;②S(s)+O2(g)===SO2(g)△H=-577 kJ/mol;根据盖斯定律可知①-②×2即得到CH4和SO2反应的热化学方程式为CH4(g)+2SO2(g)===CO2(g)+2S(s)+2H2O(g)△H=352 kJ/mol;正确答案:CH4(g)+2SO2(g)===CO2(g)+2S(s)+2H2O(g)△H=352 kJ/mol。
(2) ①达到平衡状态时,速率之比和物质前面的系数成正比,且速率方向相反;因此A点时,SO2的生成速率与S2(g)的生成速率相等,不符合系数比关系,没有达到平衡状态;B点时SO2的生成速率与S2(g)的生成速率虽然不相等,但不符合系数比关系,没有达到平衡状态;C点SO2的生成速率与S2(g)的生成速率相差2倍关系,符合系数比关系, 达到平衡状态;D点时,SO2的生成速率与S2(g)的生成速率相差不是2倍关系,不符合系数比关系,没有达到平衡状态;正确选项C。
②从图像可出,升高温度,SO2的生成速率增加较快,反应逆向移动,该反应为放热反应,△H<0;正确答案:<。
③针对于可逆反应2C(s)+2SO2(g)![]() S2(g)+2CO2(g),△H<0;降低温度,平衡右移,SO2平衡转化率增大,A正确; C为纯固体,改变其用量,速率不变,平衡不移动,SO2平衡转化率不变,B错误;减小容器体积,增大压强,平衡左移,SO2平衡转化率减小,C错误;添加高效催化剂,只能加快反应速率,平衡不动,SO2平衡转化率不变,D错误;正确选项A。
S2(g)+2CO2(g),△H<0;降低温度,平衡右移,SO2平衡转化率增大,A正确; C为纯固体,改变其用量,速率不变,平衡不移动,SO2平衡转化率不变,B错误;减小容器体积,增大压强,平衡左移,SO2平衡转化率减小,C错误;添加高效催化剂,只能加快反应速率,平衡不动,SO2平衡转化率不变,D错误;正确选项A。
(3) 电离平衡:NH3·H2O![]() NH4++OH- 已知2.0mol·L-1的氨水中,已经电离的NH3·H2O为x mol·L-1,则剩余的c(NH3·H2O)=2-x mol·L-1,c(NH4+)=x mol·L-1,c(OH-)= x mol·L-1;根据Kb(NH3·H2O)=1.8×10-5= x2/(2-x),x=0.006 mol·L-1,电离度α=
NH4++OH- 已知2.0mol·L-1的氨水中,已经电离的NH3·H2O为x mol·L-1,则剩余的c(NH3·H2O)=2-x mol·L-1,c(NH4+)=x mol·L-1,c(OH-)= x mol·L-1;根据Kb(NH3·H2O)=1.8×10-5= x2/(2-x),x=0.006 mol·L-1,电离度α=![]() ×100%=0.006/2×100%=0.3%;将含SO2的烟气通入该氨水中,当溶液显中性时,c(H+)=c(OH-)=10-7mol/L,亚硫酸氢根离子电离平衡常数Ka2(H2SO3)=c(H+)×c(SO32-)/c(HSO3-),
×100%=0.006/2×100%=0.3%;将含SO2的烟气通入该氨水中,当溶液显中性时,c(H+)=c(OH-)=10-7mol/L,亚硫酸氢根离子电离平衡常数Ka2(H2SO3)=c(H+)×c(SO32-)/c(HSO3-),![]() = Ka2(H2SO3)/c(H+)=6.2×10-8/10-7=0.62;正确答案:0.3%;0.62。
= Ka2(H2SO3)/c(H+)=6.2×10-8/10-7=0.62;正确答案:0.3%;0.62。
(4) ①NH4HSO4中硫元素为+6价,(NH4)2S2O8中硫元素为+2价,发生氧化反应,根据氧化还原反应规律,氢元素化合价降低,被还原为氢气,电解NH4HSO4溶液的化学方程式2NH4HSO4==(NH4)2S2O8+H2↑;正确答案:2NH4HSO4==(NH4)2S2O8+H2↑。
②根据公式:Q=It=9.65×60×60, 反应转移的电子物质的量为Q/ F=9.65×60×60/96500=0.36mol,根据2NH4HSO4==(NH4)2S2O8+H2↑可知,转移2 mol电子,生成1mol (NH4)2S2O8,现转移0.36mol电子,生成0.18 mol (NH4)2S2O8;正确答案:0.18。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】能在水中大量共存的一组离子是
A.NH4+、Na+、Cl-、SO42-B.H+、Na+、NO3-、CO32-
C.K+、Ba2+、OH-、SO42-D.K+、Ag+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题: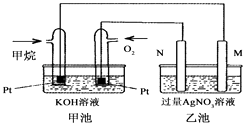
(1)M电极的材料是 , 其电极反应式为:N的电极名称是 , 电极反应式为:
(2)通入甲烷的铂电极的电极反应式为 .
(3)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为 L(标准状况下).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用化学用语表示NH3+HCl=NH4Cl中的相关微粒,其中不正确的是
A. 中子数为8的氮原子:![]() B. 氯化铵的电子式:
B. 氯化铵的电子式: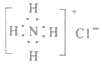
C. HCl的结构式:H-Cl D. 氯原子的结构示意图: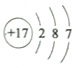
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律分析下面的推断,其中错误的是( )
A.H3PO4的酸性比HNO3弱
B.砹(At)的氢化物不稳定
C.硒(Se)化氢比硫化氢稳定
D.氢氧化钡比氢氧化钙的碱性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对电解质的叙述,正确的是( )
A.溶于水后得到的溶液能导电的物质是电解质
B.熔融状态下不能导电的化合物一定不是电解质
C.在水溶液中或熔融状态下能导电的化合物是电解质
D.能溶于水的物质是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为2CH3OH+3O2===2CO2+4H2O。下列说法中不正确的是

A. 左边的电极为电池的负极,a处通入的是甲醇
B. 每消耗3.2 g氧气转移的电子为0.4 mol
C. 电池负极的反应式为CH3OH+H2O6e===CO2+6H+
D. 电池的正极反应式为O2+2H2O+4e===4OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com