
| A. | 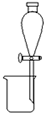 分离碘酒中的碘和酒精 | B. | 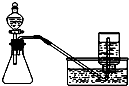 用铜和浓硝酸制取少量NO2 | ||
| C. | 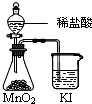 比较MnO2、Cl2、I2的氧化性 | D. | 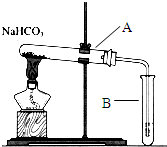 探究NaHCO3的热稳定性 |
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 1molFeI2与足量氯气反应时转移的电子数为3NA | |
| B. | 1L2mol•L-1 K2S溶液中S2-和HS-的总数为2NA | |
| C. | 标准状况下,22.4L的CCl4中含有的CCl4分子数为NA | |
| D. | 50mL18mol•L-1浓硫酸与足量铜微热反应,转移的电子数为1.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
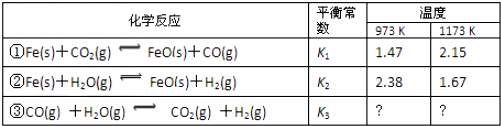
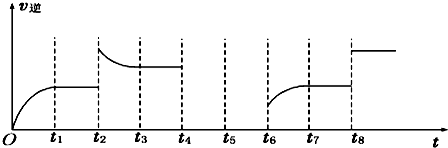
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳与石灰水反应:CO2+2OH-═CO32-+H2O | |
| B. | 溴水中通入适量的SO2:Br2+SO2+2H2O═2Br-+SO42-+4H+ | |
| C. | Cu溶于稀硝酸:Cu++2H++NO3-═Cu2++NO2↑+H2O | |
| D. | Na2O2溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 雷雨天气时空气中能生成少量的氮氧化物,属于氮的固定 | |
| B. | 实验室用氯化铵溶液和氢氧化钙溶液混合制取氨气 | |
| C. | 铵盐化学性质都很稳定 | |
| D. | O2、NO、NO2都能用浓硫酸干燥,且通常情况下能共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
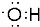 ,(CH3)3COH的名称2-甲基-2-丙醇(系统命名法)
,(CH3)3COH的名称2-甲基-2-丙醇(系统命名法)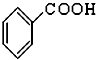 ⑤CH3CHO ⑥
⑤CH3CHO ⑥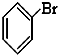
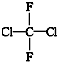 和
和 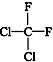 ⑥
⑥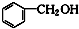 和
和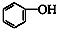 ⑦CH3CH2NO2和
⑦CH3CH2NO2和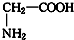
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
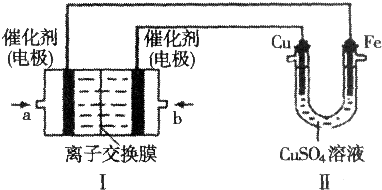
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2+CH4$→_{△}^{催化剂}$CH3COOH | |
| B. | 2CO2+6H2$→_{△}^{催化剂}$C2H5OH十3H2O | |
| C. | 2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O | |
| D. | 6CO2+6H2O$\stackrel{光照/叶绿素}{→}$C6H12O6+6O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com