
| A. | 苯 | B. | 辛烯 | C. | 辛烷 | D. | 十六烷 |
分析 选项中各物质均为烃,计算分子中C、H原子数目之比,该比值越大数目碳的质量分数越大.
解答 解:A.苯的分子式为C6H6,分子中C、H原子数目之比为6:6=1:1;
B.辛烯的分子式为C8H16,分子中C、H原子数目之比为8:16=1:2;
C.辛烷的分子式为C8H18,分子中C、H原子数目之比为8:18=1:2.25;
D.十六烷的分子式为C16H34,分子中C、H原子数目之比为16:34=1:2.125,
故苯分子中含碳的质量分数最高,
故选:A.
点评 本题考查化学式中元素质量分数有关计算,利用碳氢原子数目之比进行解答,避免计算的繁琐,关键是对质量分数的理解与灵活运用,比较基础.


科目:高中化学 来源: 题型:解答题
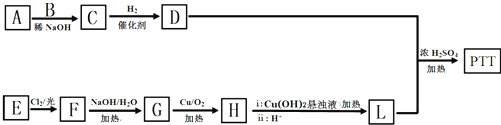
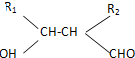
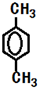 .
.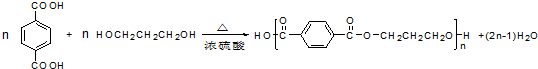 .
.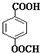 (填结构简式).
(填结构简式).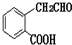 和CH3OH为有机原料制备化合物
和CH3OH为有机原料制备化合物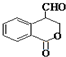 的合成路线流程图(无机试剂任选).(合成路线流程图示例如下CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).(合成路线流程图示例如下CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$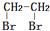 )
)查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 离子半径:W3+>Z+>Y2- | |
| B. | X、Y都存在同素异形现象 | |
| C. | Z和Y形成的化合物中只存在离子键 | |
| D. | 常温下单质W能溶于R的最高价氧化物对应水化物的浓溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 b.
b.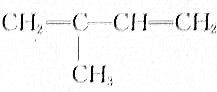
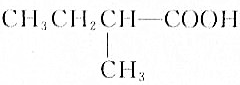 f.HOOC(CH2)4COOH
f.HOOC(CH2)4COOH 、
、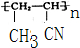
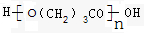
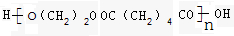 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
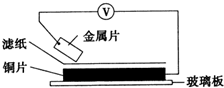 将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下:
将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下:| 金属 | 电子流动方向 | 电压/V |
| 甲 | 甲→Cu | +0.78 |
| 乙 | Cu→乙 | -0.15 |
| 丙 | 丙→Cu | +1.35 |
| 丁 | 丁→Cu | +0.30 |
| A. | 在四种金属中丙的还原性最强 | |
| B. | 金属乙能从硫酸铜溶液中置换出铜 | |
| C. | 甲、丁若形成原电池时,甲为正极 | |
| D. | 甲、乙形成合金时,将该合金露置在空气中,乙先被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和滴定时,用待测液润洗锥形瓶 | |
| B. | 酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液 | |
| C. | 用NaOH标准溶液测定未知浓度的盐酸溶液时,锥形瓶使用前中含有少量水 | |
| D. | 用标准盐酸测定未知浓度NaOH溶液,结束实验时,酸式滴定管尖嘴部分有气泡,开始实验时无气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 油脂在人体内水解为氨基酸和甘油等小分子才能被吸收 | |
| C. | 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键 | |
| D. | 3D打印技术采用钛合金粉末为原料制造飞机钛合金结构件,高温时可用金属钠还原钛的氯化物制取金属钛 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com