
【题目】Se、Br两种元素的部分信息如图所示,下列说法正确的是
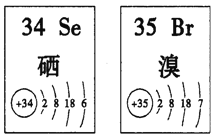
A. 原子半径:Br>Se>P B. 还原性:S2->Se2->Br-
C. SeO2既有氧化性又有还原性 D. 在Se2Br2分子中只含有极性键
科目:高中化学 来源: 题型:
【题目】(1)等温、等压下,等体积的O2和O3所含分子个数比______,质量比为_______。
(2)已知16 g A和20 g B恰好完全反应生成0.04 mol C和31.76 g D,则C的摩尔质量为_____。
(3)在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)分别用p(Ne)、p(H2)、p(O2)表示,由大到小的顺序是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)验证氯气的氧化性强于碘的实验现象是_________________________________________。
(2)B中溶液发生反应的离子方程式是____________________________________________。
(3)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是________________________________。
(4)过程Ⅲ实验的目的是_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种元素都是前36号元素,原子序数依次增大,其相关信息如下表:
元素 | 相关信息 |
A | A的第一电离能低于同周期左右相邻元素 |
B | B原子中成对电子数等于未成对电子数的2倍 |
C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
D | D与A、B、C均不同周期,其一个单质分子中只有一个σ键 |
E | E的原子序数比所处周期中未成对电子数最多的元素大3 |
(1)写出上述一种元素与氢元素形成的X2Y2型非极性分子的结构式:_______.
(2)写出E元素的元素符号:______,其价电子排布图为:_______.
(3)A与D形成化合物的化学式为 __,是_______分子(填“极性”或“非极性”)
(4)在ETiO3晶胞中(结构如图所示),1个Ti原子和1个E原子周围距离最近的O原子数目分别为__个、__个.
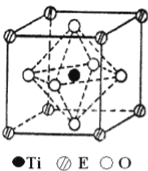
(5)叠氮酸(HN3)是一种弱酸,可部分电离出H+和N3﹣.N3﹣的空间构型为______,叠氮化物能与E3+形成配合物,则[E(N3)(NH3)5]SO4中配体是_____,E的配位数是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铜可用于有机催化剂、杀虫剂及饲料中铜的添加剂,还可用于烟火和颜料制造。CuSO4溶液与Na2CO3溶液反应能否得到碱式碳酸铜?某班同学进行相关探究。
(沉淀制备)取一定量胆矾(CuSO4·5H2O)溶于水,再滴几滴稀硫酸,充分搅拌后得到一定体积的CuSO4溶液。向其中加适量Na2CO3溶液,将所得蓝绿色悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
(1)用无水乙醇洗涤的目的是________。
(实验探究)同学们设计了如下装置,用制得的蓝绿色固体进行实验:
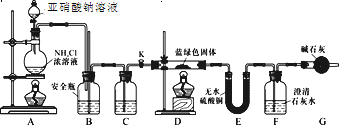
(2)D装置加热前,需要首先打开活塞K,用A装置制取适量N2,然后关闭K,点燃D处酒精灯。A中产生的N2将装置中的空气排除,避免干扰。C中盛装的试剂应是________。
(3)装置A中发生反应的离子方程式为________。
(4)若蓝绿色固体的组成为xCuCO3·yCu(OH)2,实验能观察到的现象是________。
(5)同学们查阅文献知:Ksp(CaCO3)=2.8×10-9,Ksp(BaCO3)=5.1×10-9,经讨论认为需要用Ba(OH)2代替Ca(OH)2来定量测定蓝绿色固体的化学式,其原因是________。
a.Ba(OH)2的碱性比Ca(OH)2强
b.Ba(OH)2溶解度大于Ca(OH)2,能充分吸收CO2
c.相同条件下,CaCO3的溶解度明显大于BaCO3
d.吸收等量CO2生成的BaCO3的质量大于CaCO3,测量误差小
(6)待D中反应完全后,打开活塞K,再次滴加NaNO2溶液产生N2,其目的是________。若定量分析所取蓝绿色固体质量为27.1 g,装置F中使用Ba(OH)2溶液,实验结束后,装置E的质量增加2.7 g,F中产生沉淀19.7 g。则该蓝绿色固体的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某有机化合物A 的结构,进行如下实验:
(1)将一定量的有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g H2O和8.8 gCO2,消耗氧气6.72L.(标准状况下),则该物质的实验式是_____________。
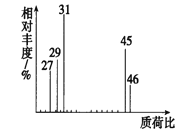
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图所示的质谱图,则其相对分子质量为________,该物质的分子式是___________。
(3)根据价键埋论;预测A的可能结构并写出结构简式:_______________________________。
(4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如甲基氯甲基醚(Cl-CH2-O-CH3,有2种氢原于)的核磁共振氢谱如图1所示:

经测定;有机物A 的核磁共振氢谱图如图2所示,则A的结构简式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,其生产工艺如下:

(1)写出工业上制取Cl2的化学方程式_____________________________________。
(2)在“反应液I”中加入KOH固体的目的是①_________________,②提供碱性环境。
(3)写出Fe(NO3)3溶液与碱性KClO溶液反应的化学方程式:______________________。
(4)K2FeO4可作为新型多功能水处理剂的原因是:
①_____________________,②_________________________。
(5)从“反应液II”中分离出K2FeO4后,副产品是_________________(写化学式)。
(6)该工艺每得到1.98 kg K2FeO4,理论上消耗Cl2的物质的量为_______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com