

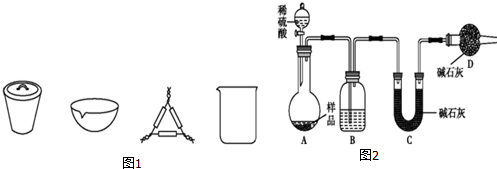
分析 (1)根据装置图可知,向烧瓶中添加浓硫酸的仪器是分液漏斗,使用分液漏斗时要检漏;
(2)浓硫酸有强氧化性,能与甲酸反应生成二氧化碳、二氧化碳等酸性气体,在实验时要除去;
(3)CO还原氧化铁时,不能有水干扰,在高温条件下,水能与铁反应,所以要干燥;
(4)因为CO为易燃气体,所以点燃D处酒精灯前,要检验从尾气出来的气体的纯度,为防止生成的生成的铁与氢氧化钠溶液中挥发出的水分反应,要等铁冷却再停止通CO气体;
(5)CO为可燃性气体,燃烧后生成二氧化碳,据此选择处理的方法;
(6)实验后测得E、B质量分别增加了yg和zg,则一氧化碳与铁的氧化物反应生成的二氧化碳的质量为yg,根据二氧化碳的质量可计算得氧化铁的质量,据此计算矿石样品中氧化铁的质量分数.
解答 解:(1)根据装置图可知,向烧瓶中添加浓硫酸的仪器是分液漏斗,使用分液漏斗时要检漏,故选c,
故答案为:分液漏斗;c;
(2)浓硫酸有强氧化性,能与甲酸反应生成二氧化碳、二氧化碳等酸性气体,在实验时要除去,所以B装置中NaOH溶液的作用除去CO中二氧化碳或二氧化硫等酸性气体,反应的离子方程式为CO2+2OH-=CO32-+H2O、SO2+2OH-=SO32-+H2O,
故答案为:CO2+2OH-=CO32-+H2O、SO2+2OH-=SO32-+H2O;
(3)CO还原氧化铁时,不能有水干扰,在高温条件下,水能与铁反应,所以要干燥,则C中应装有浓硫酸,
故答案为:浓硫酸;
(4)因为CO为易燃气体,所以点燃D处酒精灯前,要检验从尾气出来的CO的纯度,为防止生成的生成的铁与氢氧化钠溶液中挥发出的水分反应,要等铁冷却再停止通CO气体,所以实验结束后,应先熄灭D处酒精灯,
故答案为:检验从尾气出来的CO的纯度;D;
(5)CO为可燃性气体,燃烧后生成二氧化碳,故选 c;
(6)实验后测得E、B质量分别增加了yg和zg,则一氧化碳与铁的氧化物反应生成的二氧化碳的质量为yg,根据反应3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$3CO2+2Fe可知,氧化铁的质量为$\frac{160}{44×3}$×yg=$\frac{40}{33}$yg,所以矿石样品中氧化铁的质量分数为$\frac{\frac{40}{33}y}{x}$×100%=$\frac{40y}{33x}$×100%,
故答案为:$\frac{40y}{33x}$.
点评 本题考查了学生对金属冶炼原理的理解,也考查了学生的实验能力、计算能力,注意对实验基本知识的掌握,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3 | B. | HCl | C. | BaCl2 | D. | NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用丁达尔效应可以区分溶液和胶体 | |
| B. | 加热饱和FeCl3溶液可制取Fe(OH)3胶体 | |
| C. | 利用焰色反应可以鉴别NaCl、KNO3、Na2SO4 | |
| D. | 用Ca(OH)2溶液可以区分Na2CO3和NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②⑤ | C. | ②④⑤ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两溶液的物质的量浓度相同 | |
| B. | 两溶液的c(H+)相同 | |
| C. | 等体积的两溶液分别与足量Zn反应,产生H2的量不同 | |
| D. | 将两溶液均稀释100倍后,pH不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量Na2O2固体加入到Ca(HCO3)2溶液中,溶液中有反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | 铁和稀盐酸反应:2Fe+6H+═3H2↑+2Fe3+ | |
| C. | 在氢氧化钡溶液中加入少量小苏打:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| D. | 硝酸铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Na+、SO42-、H2O2 | B. | SO32-、MnO4-、H+、K+ | ||
| C. | Pb2+、K+、SO42-、Cl- | D. | Na+、SO32-、K+、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com